Публикации
Информация для специалистов
Информация предназначена для специалистов здравоохранения и не может быть использована иными лицами, в том числе для замены консультации с врачом и для принятия решения о применении данных препаратов!
Системная антимикотическая терапия хронического грибкового риносинусита
Системная антимикотическая терапия хронического грибкового риносинусита
В настоящее время наблюдается рост числа воспалительных заболеваний полости носа и околоносовых пазух (ОНП)[1]. При этом остаётся неоспоримым феномен постоянного роста заболеваемости микозами данной локализации [2-6].
Внедрение в клиническую практику новых медицинских технологий (трансплантация органов, высокодозная иммуносупресcивная терапия, инвазивные диагностические и лечебные процедуры), пандемия ВИЧ-инфекции и широкое применение антибактериальных препаратов привели к увеличению популяции иммуноcкомпрометированных пациентов с высоким риском развития инвазивных микозов [7,8]. Возросли не только число и тяжесть грибковых инфекций в оториноларингологии, но также отмечается тенденция к расширению и изменению спектра микобиоты [9]. При диагностике микозов врачи-практики и работники лабораторной службы часто испытывают большие затруднения [10,11].
Основу лечения микозов составляет применение противогрибковых препаратов (антимикотиков). При этом у различных видов грибов существует первичная (природная) резистентность к тем или иным антимикотикам, а широкое применение этих препаратов в целях профилактики и терапии микозов в последние годы привело к росту вторичной устойчивости (в первую очередь, к флуконазолу) [12]. Для эффективной терапии микозов необходимым условием является проведение видовой идентификации и определение чувствительности возбудителей к противогрибковым препаратам [9-12]. Подбор подходящего антимикотика на основе определения чувствительности возбудителя in vitro является экономически более эффективным, чем эмпирическая замена одного препарата другим [9,11]. Однако отсутствие доступной (простой в исполнении, экономичной и легко воспроизводимой) методики определения чувствительности грибов не позволяет проводить эти исследования в каждой лаборатории клинической микробиологии. Таким образом, изучение спектра возбудителей микозов носа и ОНП и чувствительности к противогрибковым препаратам является актуальной проблемой оториноларингологии и медицинской микологии в целом. Её решение в дальнейшем позволит разработать рекомендации для рациональной эмпирической антимикотической терапии грибковых риносинуситов.
К сожалению, в нашей республике наблюдается дефицит информации по медицинской микологии в целом. У многих оториноларингологов (и врачей других специальностей) диагноз «микоз» ассоциируется с назначением нистатина и флуконазола. Для специфического противогрибкового лечения в настоящее время используется целый ряд эффективных препаратов как системного, так и местного применения. Первыми в микологии применялись полиеновые антибиотики: нистатин, натамицин, амфотерицин В. Первые два препарата для системной терапии не используются вследствие низкой биодоступности (3-5%). Более 40 лет используется и не потерял своей значимости в лечении глубоких микозов амфотерицин В. Его главное преимущество – наиболее широкий спектр противогрибковой активности. Однако его использование ограничено высокой токсичностью препарата, отсутствием пероральной формы. Действенным методом снижения токсичности амфотерицина В является применение его липосомальных форм [13]. Сейчас в России зарегистрирован препарат «Амбизон», но значительным его недостатком является высокая цена.
Внедрение триазолов (итраконазол, флуконазол) можно справедливо назвать революцией в терапии микозов. Впервые стали возможны безопасное лечение и профилактика ряда глубоких микозов. (Следует отметить, что первый из предложенных «системных» азолов — кетоконазол — после введения в клиническую практику итраконазола свое значение практически утратил ввиду высокой токсичности и в настоящнее время чаще используется местно). Иногда у лечащих врачей создается впечатление о клинической равноценности, и даже идентичности этих препаратов. Однако итраконазол и флуконазол отличаются друг от друга по основным характеристикам и имеют свои показания и особенности назначения.
Механизм действия азолов основан на угнетении синтеза эргостерина за счет действия на зависимый от системы цитохрома Р-450 фермент 14a-деметилазу, что обуславливает фунгицидный эффект. Флуконазол наиболее активен в отношении большинства дрожжевых грибов: возбудителей кандидоза (С.albicans, C.parapsilosis, C.tropicalis, C.lusitaniae и др.), криптококка и кокцидиоида, но неактивен в отношении плесневых и некоторых дрожжевых грибов (C.krusei, C.glabrata, C.norvegensis), которые часто являются возбудителями глубоких микозов, особенно в группе иммуноскомпрометированных больных. В последнее десятилетие довольно остро встаёт проблема вторичной резистентности Candida spp. к флуконазолу связи с широким и бессистемным его применением [8,12]. Из двух рассматриваемых препаратов итраконазол отличается самым широким спектром действия (дрожжевые + плесневые грибы) in vitro и in vivo. Спектр действия итраконазола включает Candida spp., Cryptococcus neoformans, Aspergillus spp., дерматофиты, Malassezia furfur, грибы Dematiaceae, Pseudallescheria boydii и всех диморфных возбудителей микозов. Устойчивость к итраконазолу развивается крайне медленно.
Флуконазол и итраконазол хорошо всасываются в ЖКТ. При этом для всасывания итраконазола необходим достаточный уровень кислотности в желудке, поскольку, реагируя с соляной кислотой, он превращается в хорошо растворимые гидрохлориды. Биодоступность итраконазола, назначаемого в виде капсул, выше при приеме с пищей. Препараты азолов при приеме внутрь следует запивать достаточным количеством воды. При пониженной кислотности в желудке эти препараты рекомендуется принимать с напитками, имеющими кислую реакцию (например, с колой).
Во время лечения системными азолами нельзя принимать терфенадин, астемизол, а при лечении итраконазолом — ловастатин и симвастатин. Пиковые концентрации в крови флуконазола достигаются через 1–2 ч, итраконазола – через 2–4 ч. Итраконазол, будучи высоко липофильным, распределяется преимущественно в органы и ткани с высоким содержанием жира: печень, почки, большой сальник. Способен накапливаться в тканях, которые особо предрасположены к грибковому поражению, таких как кожа (включая эпидермис), ногтевые пластинки, легочная ткань, слизистая ВДП, где его концентрации почти в 7 раз выше, чем в плазме. В воспалительных экссудатах уровни итраконазола в 3,5 раза превышают плазменные. В то же время, в «водные» среды — слюну, внутриглазную жидкость, СМЖ — итраконазол практически не проникает. Пациентам с нейтропенией и больным СПИДом может потребоваться увеличение дозы [7,8].
Для всех системных азолов наиболее частыми являются побочные явления со стороны ЖКТ (боль в животе, нарушение аппетита, тошнота, рвота, диарея, запор), печени (повышение активности трансаминаз, холестатическая желтуха). По данным литературы, частота возникновения побочных реакций на итраконазол составляет 18-25% [7,8,14]. Такие препараты, как гризеофульвин и тербинафин, эффективны только при дерматофитии.
В последнее время в Беларуси зарегистрированы новейшие антимикотики: вориконазол (триазолы) и каспофунгин (эхинокандины), отличающиеся широчайшим спектром действия [13]. Они уже успешно применяются в онкогематологических стационарах республики, но более широкое внедрение в практику ограничено высокой стоимостью препаратов.
Таким образом, при выборе препарата для системной антимикотической терапии (АМТ) хронического грибкового риносинусита следует руководствоваться следующими критериями:
• действие на наиболее вероятных возбудителей риносинусита
• хорошая переносимость
• биодоступность и проникновение в очаг поражения (ВДП, ОНП)
• доступная стоимость курса лечения (фармакоэкономические показатели).
В связи с этим целью нашей работы явилось изучение спектра микобиоты при хронических грибковых синуситах и уровня резистентности к основным антимикотическим препаратам для проведения рациональной терапии, а также оценка эффективности применения итраконазола при данной патологии.
Материалы и методы.
В исследование включены 35 пациентов, которые находились на лечении в ЛОР-клинике Гомельского государственного медицинского университета в 2006-2008гг. Из них мужчин - 12 (34,3%), женщин - 23 (65,7%), в возрасте от 18 до 75 лет (средний возраст – 35+_7,1лет). Во всех случаях подтверждена грибковая или грибково-бактериальная этиология синусита. В работе использовали классификацию грибковых риносинуситов (Лопатин А.С., 1999, 2002; de Shazo R.D. et al., 1998 )[3,5,6]:
острый (молниеносный) инвазивный риносинусит – риноцеребральный мукороз
хронический грибковый инвазивный риносинусит
неинвазивный синусит (мицетома ОНП)
аллергический (эозинофильный) грибковый риносинусит
Диагностика базировалась на комплексе методов: ЛОР-осмотр, оптическая риноскопия, рентгенологическое исследование (компьютерная и магнитно-резонансная томография), гистологическое, иммунологическое и, особенно важно, микробиологическое исследование. Забор материала из ОНП производился при пункции или интраоперационно до начала антибактериальной и антимикотической терапии. Транспортировка осуществлялась в течение 2-4 часов в пробирках на угольной среде Амиеса (ООО Хема-Медика, Индия). Идентификация, определение чувствительности грибов и анализ полученных данных проводился с помощью микробиологического анализатора miniAPI фирмы bioMerieux (Франция). Исключены культуры, не имеющие клинического значения. Определение чувствительности к противогрибковым препаратам (амфотерицину В, флуконазолу, итраконазолу и вориконазолу) проводилось на стрипах (ATB FUNGUS-3) фирмы bioMerieux (Франция) в полужидкой среде, адаптированной к требованиям стандартного метода разведений Института клинических лабораторных стандартов (CLSI)- NCCLS М-44, США. Для контроля качества определения чувствительности использовались контрольные штаммы американской коллекции микроорганизмов (ATCC).
 Лечение включало целый комплекс методов: хирургический, антимикотическая и антибактериальная терапия, муколитики, антигистаминные препараты, иммунокоррекция, физиотерапевтическое лечение. При проведении системной АМТ использовали итраконазол (Микотрокс) в капсулах по 100 мг, производства компании Фармакар (Палестина-Германия). Длительность динамического наблюдения за группой пациентов составила от 6 месяцев до 2-х лет с кратностью – 2 недели, 1-3 месяца, затем 2 раза в год. Оценка клинической эффективности лечения осуществлялась по следующим критериям:
Лечение включало целый комплекс методов: хирургический, антимикотическая и антибактериальная терапия, муколитики, антигистаминные препараты, иммунокоррекция, физиотерапевтическое лечение. При проведении системной АМТ использовали итраконазол (Микотрокс) в капсулах по 100 мг, производства компании Фармакар (Палестина-Германия). Длительность динамического наблюдения за группой пациентов составила от 6 месяцев до 2-х лет с кратностью – 2 недели, 1-3 месяца, затем 2 раза в год. Оценка клинической эффективности лечения осуществлялась по следующим критериям:
• излечение - полное исчезновение симптомов синусита на момент окончания лечения, отсутствии обострений в течение года;
• улучшение (ремиссия) – исчезновение/уменьшение симптомов синусита на момент окончания лечения;
• отсутствие эффекта – сохранение основных симптомов заболевания по окончании курса лечения;
• рецидив – нивелирование всех исходных симптомов к концу лечения с последующим появлением их в течение 12 месяцев.
Критерии микологической эффективности: эрадикация – полное отсутствие грибов при микроскопии и культуральном 3-хкратном исследовании мазков из носа и ОНП; отсутствие эрадикации – выделение хотя бы одной колонии микромицетов. Анализ нежелательных реакций проводился у всех пациентов независимо от длительности применения итраконазола (контроль ОАК, БАК ежемесячно).
Результаты и обсуждение.
По нашим данным, наиболее частой формой грибкового синусита была мицетома ОНП – 25 чел. (71,4%). При этом мицетомы чаще локализовались в верхнечелюстной пазухе (ВЧП) – 21 случай (84%), ВЧП+ клетки решетчатого лабиринта (РЛ) – 4 случая (16%). Хроническая инвазивная форма грибкового синусита отмечена в 8 (22,9%) случаях. Аллергический грибковый риносинусит – в 2 случаях (5,7%). В наших исследованиях микробиологическое подтверждение микотической природы синусита отмечено в 24 случаях (68,5%) (рис 1, 2), гистологическое – в 8 (23%), микологическое + гистологическое – 2 (5,7%). В 1 (2,8%) случае диагноз хронического инвазивного грибкового риносинусита выставлен только клинически (ex uvantibus).
Рис. 1 Рост колоний Aspergillus fumigatus Рис. 2 Рост колоний Aspergillus fumigatus
на кровяном агаре. на среде Сабуро.
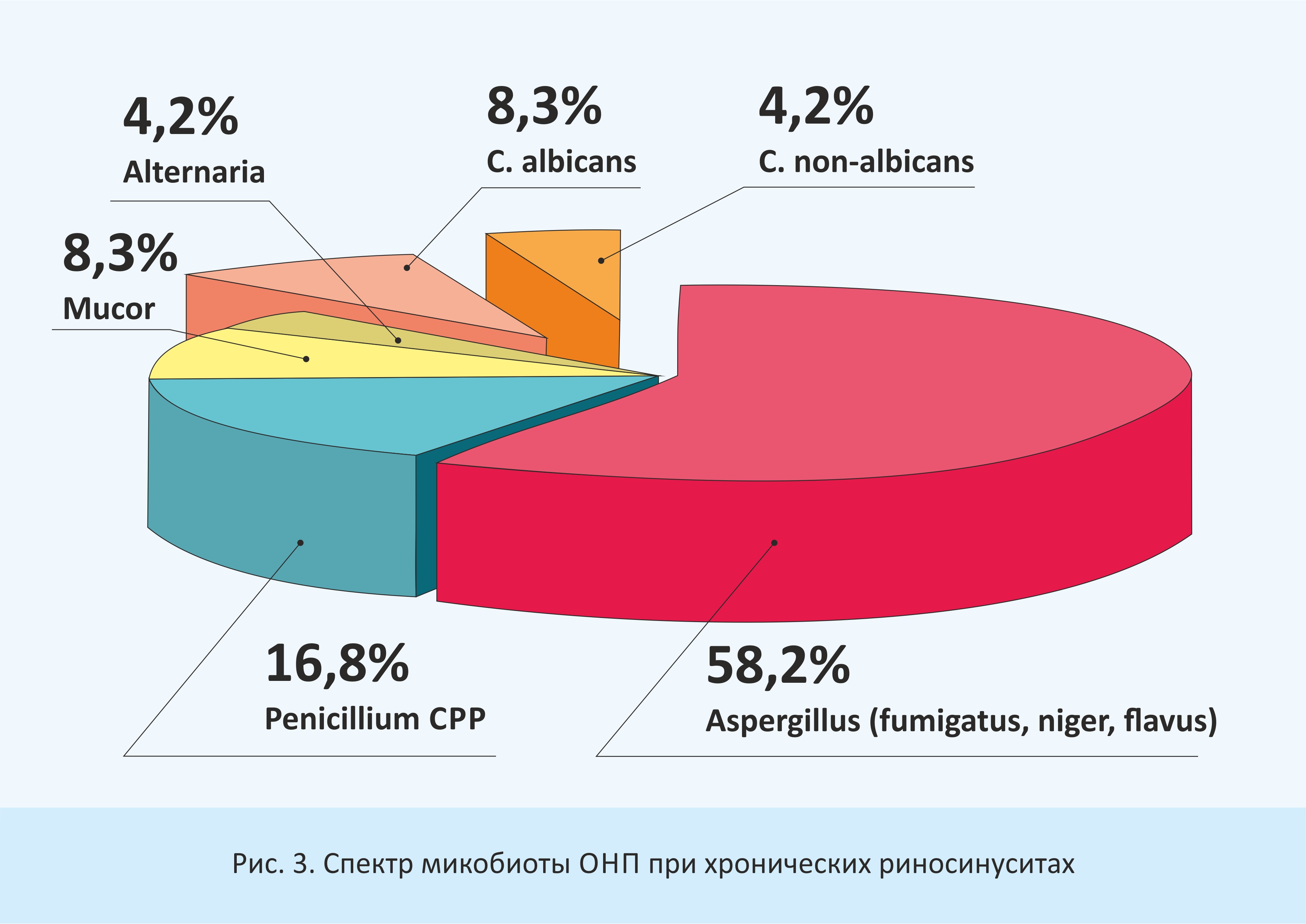
При анализе результатов микологического исследования мы выявили, что при грибковых риносинуситах наибольшее значение имеет мицелиальная (плесневая) микобиота: Aspergillus spp. (fumigatus, niger, flavus) - 18 (52,9%), Penicillium spp. 6 (17,6%), Mucor 4 (11,8%), Alternaria 1 (2,9%); значительно реже встречаются дрожжевые микромицеты: C. albicans - 3 случая (8,8%) и C. non-albicans (krusei)- 2 случая (5,9%) (рис.3).
Рис. 3. Спектр микобиоты ОНП при хронических риносинуситах
Суммарная оценка чувствительности к противогрибковым препаратам выделенных 26 штаммов микромицетов представлена на рис.4. Необходимо отметить, что все плесневые грибы (100%) (Aspergillus, Penicillium, Alternaria) и C. non-albicans резистентны к флуконазолу. C. albicans сохраняет высокую чувствительность к флуконазолу (100%). Резистентность к итраконазолу выявлена у C. krusei в 1 случае (2,9%). К сожалению грибки рода Mucor культуральным методом выделить не удалось, соответственно мы не получили данных по их антимикотикорезистентности. Таким образом, исходя из полученных результатов по антимикотикочувствительности выделенных штаммов, препаратами выбора при лечении грибковых риносинуситов являются итраконазол, амфотерицин В, вориконазол. Назначение флуконазола оправдано только при подтверждении этиологической роли С.albicans.

Рис.4 Суммарная антимикотикочувствительность микромицетов, выделенных из ОНП.
Но даже чувствительность к препарату in vitro не означает эффективность терапии, так как при выборе препарата необходимо учитывать фармакокинетику и локализацию патологического очага, наличие тяжёлой сопутствующей патологии и иммунодефицита. ВЧП – закрытая полость, труднодоступна для любого системного препарата. Поэтому вполне обоснованно местное применение амфотерицина В (раствор в 5% глюкозе 250000 ЕД однократно в сутки) в виде ингаляций и промывания ОНП. В большинстве случаев грибковых синуситов необходимо сочетание хирургического лечения с системной и(или) местной АМТ.
В постоперационном периоде проводилось промывание пазухи раствором амфотерицина В, ингаляции через нос с этим же препаратом (7-10 процедур). Излечение отмечено в 100% случаев. Рецидивов не наблюдалось, что подтверждает мнение других авторов о нецелесообразности назначения системной АМТ при мицетоме ОНП [2,3,5,6]. На наш взгляд, оправдано было назначение системной АМТ (минимальный курс 14 дней) при синус-мицетоме (2 случая) в случае отсутствии уверенности в неинвазивности процесса (нет данных КТ, МРТ, интраоперационная макрокартина).
При инвазивной форме микотического синусита (8 больных) в 100% случаев выполнена радикальная операция на ВЧП, решетчатом лабиринте, с последующей системной и местной АМТ. Длительность АМТ определяли индивидуально – от 1 до 6 месяцев. Ремиссия достигнута в 91,7% случаев, рецидив синусита отмечен в 16,7%. Мы придерживались консервативной тактики лечения аллергического грибкового риносинусита: итраконазол 200мг в сутки 1 месяц, ингаляции с амфотерицина В, антигистаминные препараты, назальные кортикостероиды. В обоих случаях удалось добиться ремиссии, в течение 6 месяцев обострений синусита не было (динамическое наблюдение продолжается). Во всех 12 случаях (100%) системной терапии итраконазолом (Микотрокс) удалось добиться микологической эффективности по окончании курса лечения.
При местном применении амфотерицина В побочные явления минимальны – першение и сухость в глотке (4 случая), тошнота (1 случай). Следует отметить хорошую переносимость итраконазола (Микотрокс) у 9 больных (75%); только у 2 пациентов (16,7%) в первую неделю лечения появились тошнота и неустойчивый стул, но эти симптомы нивелированы коррекцией диеты без уменьшения дозы препарата. В 1 случае (8,3%) пациент отмечал тяжесть в области правого подреберья и горечь во рту после месячного курса лечения (суточная доза 400 мг), при этом отклонений в общем и биохимических анализах крови не зафиксировано (в частности АлТ, АсТ). После уменьшения суточной дозы итраконазола до 200 мг и назначения гепатопротекторов побочные явления купированы. Ни в одном из 3 случаев не потребовалось полной отмены препарата. Аллергических реакций не было.
На основании проведенного нами исследования можно сделать вывод, что итраконазол (Микотрокс) соответствует всем вышеизложенным критерииям к системной АМТ и является препаратом выбора при хронических грибковых риносинуситах.
Представляем случай из практики. Больная Г., 75 лет поступила в клинику с жалобами на ноющую боль и припухлость в области правой щеки, гнойные зловонные выделения из правой половины носа. Из анамнеза стало известно, что болеет около 3,5 мес., лечилась амбулаторно (антибиотикотерапия, пункции и промывание правой ВЧП) с незначительным временным улучшением. В связи с неэффективностью амбулаторного лечения и ухудшением состояния направлена в ЛОР-клинику. Объективно: общее состояние удовлетворительное, небольшая инфильтрация и болезненность при пальпации в области передней стенки правой ВЧП, при риноскопии – искривление носовой перегородки вправо, гнойные выделения в ОНХ справа, отёк и гиперемия слизистой ННР и СНР, зубы – протезирована. Остальные ЛОР-органы без патологии. На рентгенограмме ОНП – тотальное негомогенное затемнение правой ВЧП, остальные пазухи воздушны. При пункции ВЧП – жидкий гной. На фоне антибактериальной и противовоспалительной терапии, ежедневных пункций и промывании правой ВЧП больная отмечает значительное улучшение – выделения из носа прекратились, боль в области правой щеки не беспокоит, но сохраняется инфильтрация в этой же области. Больной произведена компьютерная томография лицевого черепа – в правой ВЧП негомогенное затемнение, содержимое, с фрагментами костной плотности, разрушение по нижней стенке (рис. 5).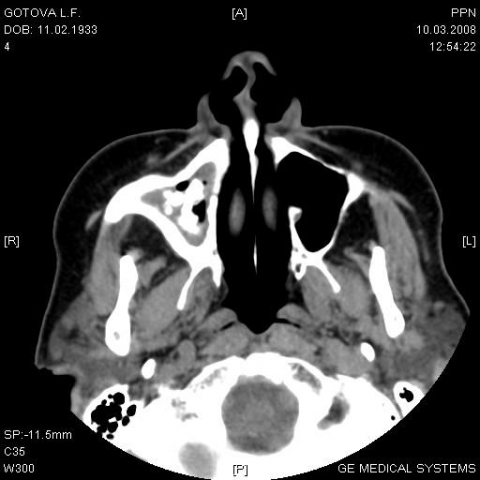
Рис. 5 КТ-картина инвазивного грибкового поражения правой ВЧП.
Выставлен клинический диагноз: хронический гнойный верхнечелюстной синусит справа, обострение. Вторичная невралгия I-II ветвей N.trigeminus справа. Органическое заболевание правой ВЧП? (адамантинома верхней челюсти?). Для уточнения диагноза произведена гайморотомия (РО) по Калделл-Люку справа: в пазухе обнаружена полипозно-изменённая слизистая, по передней и нижней кариозно-изменённой стенке казеозно-некротические массы с костными фрагментами. Произведена радикальная операция на правой ВЧП, тщательно удалено всё патологическое содержимое.
Патогистологическое заключение: остеомиелит верхней челюсти, некротический дедрит, нити мицелия Asp. fumigatus, данных за новообразование нет. Микробиологическое исследование: получен рост Fusobacterium (анаэробы)10´7, S – метронидазол, клиндамицин; роста грибков не получено. Выставлен заключительный диагноз: Хронический инвазивный грибково-бактериальный верхнечелюстной синусит справа, обострение. Вторичная невралгия I-II ветвей N.trigeminus справа. В послеоперационном периоде получала клиндамицин 300 мг и итраконазол 200 мг в сутки, ежедневное промывание ВЧП растворами мирамисцина, амфотерицина В, ингаляции через нос с амфотерицином В. Выписана с улучшением, рекомендовано продолжить лечение амбулаторно: клиндамицин 300 мг в сутки 10 дней, итраконазол 200 мг в сутки в течении 2 месяцев. Через 2 месяца больная поступает повторно со схожей клиникой обострения верхнечелюстного синусита справа. Как выяснилось позже – лечение амбулаторно не принимала (по социальным причинам). Объективно: при оптической риноскопии скудное гнойное отделяемое в ОНХ и ВЧП справа, искусственное соустье свободно проходимо, на дне ВЧП грибковые массы чёрного цвета. При повторном микробиологическом исследовании – роста не получено. Назначено консервативное лечение (ежедневное промывание р-рами антисептиков, амфотерицина В, метронидазол 500мг 3р. в день, итраконазол 200 мг в сутки). Динамика положительная, через 10 дней выписана с улучшением, даны рекомендации по амбулаторному лечению (продолжить приём итраконазола 200 мг в сутки 1 месяц). При дальнейшем динамическом наблюдении в течение 3 месяцев обострения заболевания не отмечено, жалобы со стороны ЛОР-органов отсутствуют.
Таким образом, данный клинический пример подтверждает тот факт, что грибковые синуситы не имеют патогомоничных симптомов, протекают под маской других заболеваний (в частности новообразования ВЧП), поэтому диагностика их сложна и требует комплексного подхода. Также наглядно показана обоснованность и эффективность применения итраконазола при инвазивных формах грибкового синусита.
Выводы.
1. Доминирующее (85,3%) этиологическое значение при грибковых риносинуситах имеет плесневая микобиота (Aspergillus spp., Penicillium spp.).
2. Для проведения системной антимикотической терапии синусита препаратом выбора является итраконазол (Микотрокс®). Препаратами резерва в современных условиях являются вориконазол и амфотерицин В.
3. Итраконазол (Микотрокс®) является эффективным и безопасным препаратом при лечении синуситов микотической этиологии.
4. С целью повышения эффективности лечения хронических грибковых риносинуситов показано использование методов идентификации и определения антимикотикочувствительности возбудителей микозов.
Литература:
1. Семак, Л.И. Синуситы в структуре госпитальной ЛОР-патологии/ Л.И. Семак, А.Р. Сакович // Новые технологии в оториноларингологии: материалы VI съезда оториноларингологов РБ, Гродно, 15-16 мая 2008г./ Грод. гос. мед. ун-т, редкол.: А.Ч. Буцель [и др.]. – Минск, 2008. – С.131-132.
2. Заболотный, Д.И. Роль грибов в патологии верхних дыхательных путей и уха/ Д.И. Заболотный, И.С. Зарицкая, О.Г. Вольская// Журн. ушн. нос. и горл. бол.-2002. – №5. – С.2 – 15.
3. Лопатин, А.С. Грибковые заболевания околоносовых пазух / А.С. Лопатин // Российская ринология. – 1999. – №1. – С. 46 – 48.
4. Ponikau, J.P. The Diagnosis and Incidence of Allergic Fungal Sinusitis / J.P. Ponikau [et al.] // Mayo Clinic Proceedings. – September., 1999. Vol. 74. – P.877-884.
5. deShazo, R.D. Fungal Sinusitis / R.D. deShazo, K. Chapin, R.E. Swain // New England J. of Med. – 1997. – Vol. 337. – P.254 – 259.
6. Metson, M.D. Fungal sinusitis // M.D. Metson, S.N. Mardon, B. Ralph // The Harward medical school guide to healing your sinuses / M.D. Metson, S.N. Mardon, B. Ralph – New York, 2005. – P.153-157.
7. Климко, Н.Н. Принципы лечения микозов/ Н.Н. Климко// Микозы: диагностика и лечение: руководство для врачей/ Н.Н. Климко. – М., 2007. – Гл.3 – С.35-87.
8. Сергеев, А.Ю. Современные антимикотики и принципы противогрибковой терапии/ А.Ю. Сергеев, Ю.В. Сергеев // Грибковые инфекции: руководство для врачей/ А.Ю. Сергеев, Ю.В. Сергеев – М., 2004. – Гл.2– С.55-143.
9. Тастанбекова, Л.К. К вопросу изучения плесневых грибов при микозах ЛОР-органов/ Л.К. Тастанбекова // Вестник Казахского Национального медицинского университета. – 2004. - №1(23). – С.78-80.
10. Аравийский, Р.А Диагностика микозов/ Р.А. Аравийский, Н.Н. Климко, Н.В.Васильева – СПб: Издательский дом СПбМАПО, 2004. – 186с.
11. Елинов, Н.П. Аспергиллёзная инфекция: подходы к диагностике и лечению/ Н.П. Елинов, В.С. Митрофанов, Р.М. Чернопятова // Проблемы медицинской микологии. – 2002. – Т.4.-№1.-С.1-14.
12. Веселов, А.В. Эпидемиология возбудителей кандидозов и их чувствительность к азолам: результаты исследования ARTEMIS Disk/ А.В.Веселов [и др.]// Клин.микробиол.антимикроб.химиотерапия, 2005.—том 7. – №1. – С.68-76.
13. Климко, Н.Н. Новые препараты для лечения инвазивных микозов/ Н.Н. Климко, А.В. Веселов// Клин.микробиология и антимикроб. химиотерапия. – 2003. – №4. - Т.5 – С.342-353.
14. Martin, M.V. The use of fluconazole and itraconazole in the treatment of Candida albicans infections: a rewiew/ M.V. Martin // J. Antimicrob. Chemother. – 1999. – Vol.44. – P. 429-437.

