Публикации
Информация для специалистов
Информация предназначена для специалистов здравоохранения и не может быть использована иными лицами, в том числе для замены консультации с врачом и для принятия решения о применении данных препаратов!
Цефдинир как пероральный цефалоспорин III поколения: роль в современной клинической практике
Цефдинир как пероральный цефалоспорин III поколения: роль в современной клинической практике
В статье рассмотрены значение и актуальные вопросы применения пероральных цефалоспоринов III поколения в амбулаторной клинической практике на примере цефдинира с современных позиций политики управления назначением антибиотиков и доказательной медицины, а также представлен клинический случай успешного лечения цефдиниром пациентки с внебольничной пневмонией, развившейся на фоне хронического бронхита.
Вопросы оптимального использования антибактериальных лекарственных средств в настоящее время являются одними из ключевых для амбулаторной клинической практики. Это объясняется рядом моментов. Цефдинир как пероральный цефалоспорин III поколения: роль в современной клинической практике.
Во-первых, антибиотики по-прежнему очень часто назначаются избыточно, в тех ситуациях, когда можно было рекомендовать пациенту лишь патогенетическое и симптоматическое лечение. Так, одними из самых распространенных патологических состояний в практике амбулаторного врача являются инфекции верхних дыхательных путей преимущественно вирусной этиологии, и только весьма малая их часть вызвана бактериями [1, 2]. Несмотря на это, в разных странах мира практически 72% таких пациентов назначается антибиотикотерапия, что составляет до 41% от всех антибиотиков, используемых вне стационаров [3, 4]. Необоснованное применение антибактериальных лекарственных средств приводит к высокому риску потенциально предотвратимых нежелательных эффектов, в том числе жизнеугрожающих (C. difficile-ассоциированные псевдомембранозный колит и токсический мегаколон, анафилаксия, острое повреждение почек и печени и т.д.), без какой-либо пользы для пациента.
Во-вторых, чрезмерное использование антибиотиков амбулаторно непосредственно ассоциировано с растущей в популяции селекцией и стремительным распространением устойчивых к этиотропным средствам возбудителей [2, 5]. Это в свою очередь ограничивает врачей в возможностях лечения в будущем пациентов с реальными бактериальными инфекциями, значительно уменьшает разнообразие доступных клинически эффективных антибиотиков в амбулаторной практике, заставляет использовать антибиотики с все более широким охватом возбудителей и по механизму замкнутого круга потенцирует возникновение все более резистентных микроорганизмов.
В-третьих, сегодня в аптеках доступно огромное разнообразие антибактериальных лекарственных средств, как рецептурных, так и отпускаемых без рецепта, и нередко врачу сложно понять, какой вариант терапии предпочтителен в той или иной клинической ситуации. С позиций оптимальной политики управления назначением антибиотиков (часто называемой в отечественной литературе стратегией контроля за антибактериальной терапией) предпочтение всегда следует отдавать антибиотику с минимально достаточным спектром активности (и соответственно, меньшим влиянием на селекцию антибиотикорезистентных патогенов – концепция минимализации «параллельного ущерба») в отношении ключевых возбудителей инфекции той или иной локализации, с наименьшей частотой нежелательных эффектов и оптимальным соотношением цены и качества.
Цефалоспорины относятся к группе основных и наиболее часто используемых в современной клинической практики антибиотиков, обладают высокой активностью в отношении ключевых внебольничных патогенов и хорошим профилем безопасности, присущим всем бета-лактамам. В то же время при большинстве нозологий они по-прежнему не являются средствами первой линии и резервируются для тех клинических ситуаций, где польза от их применения будет максимальной.
Цель данной публикации – рассмотреть ключевые инфекции, с которыми встречается врач в амбулаторных условиях, и определить для них оптимальные позиции назначения пероральных цефалоспоринов III поколения на примере одного из ключевых представителей данного класса – цефдинира.
Цефдинир впервые был синтезирован в 1988 году и после ряда исследований одобрен в декабре 1997 года Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США для применения в клинической практике [6]. Как и другие бета-лактамные антибиотики, цефдинир связывается с пенициллинсвязывающим белком бактерий, нарушая формирование их клеточной стенки и вызывая необратимую гибель микроорганизмов. Данный антибиотик высоко активен в отношении классических респираторных возбудителей (Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Neisseria spp., Streptococcus pyogenes) и большинства энтеробактерий. Кроме того, в отличие от многих других пероральных цефалоспоринов III поколения, он сохраняет высокую активность и в отношении Staphylococcus aureus [6]. Ниже мы рассмотрим ключевые нозологии в практике амбулаторного врача, при которых назначение цефдинира продемонстрировало высокую микробиологическую и клиническую эффективность.
Тонзиллофарингит. Данное состояние представляет собой остро развивающееся воспаление лимфоидных образований глоточного кольца (чаще всего небных миндалин) и слизистой ротоглотки, может быть острым и хроническим (в том числе часто рецидивирующим). Острый тонзиллофарингит чаще имеет вирусную этиологию (до 70% всех случаев у детей и до 90% у взрослых) и вызывается, прежде всего, аденовирусами, вирусом Эпштейна-Барр и цитомегаловирусом, коронавирусами (в том числе SARS-CoV-2), риновирусами, респираторно-синтициальным вирусом, вирусами гриппа и парагриппа и другими [7]. В случае бактериального острого тонзиллофарингита у детей ключевым возбудителем считается S. pyogenes (b-гемолитический стрептококк группы А, БГСА) – до 20-30% всех случаев, особенно в зимне-весенний период у детей в возрасте 5-15 лет, в то время как у взрослых его роль более ограничена, составляя лишь до 5-15% всех случаев [8, 9]. У подростков и молодых взрослых на первый план выходит другой возбудитель бактериального острого тонзиллофарингита – анаэробная грамотрицательная палочка Fusobacterium necrophorum [10–12]. Так, в систематическом обзоре 6 исследований было продемонстрировано, что F. necrophorum значительно чаще выявляется у пациентов с клинической картиной тонзиллофарингита по сравнению с пациентами без соответствующей клинической симптоматики (21,2% против 7,6%, р<0,001), при этом возбудитель особенно часто определялся в группе курящих молодых (15-25 лет) мужчин с выраженным экссудативным процессом на поверхности миндалин [13]. Данный возбудитель также ассоциирован с рецидивирующим (хроническим) тонзиллофарингитом [14] и болезнью Лемьера (инфекцией окологлоточных пространств с септическим тромбофлебитом внутренней яремной вены, бактериемией и метастатическими осложнениями) [15].
Несмотря на то, что вирусный тонзиллофарингит – крайне распространенное заболевание, большинство пациентов, обращающихся к врачу, будут иметь бактериальную этиологию процесса. Связано это с тем, что острые респираторные инфекции верхних дыхательных путей в большинстве случаев протекают легко, и пациенты успешно справляются самостоятельно. Если же выражены боли в горле, пациент утрачивает способность нормально глотать, длительно сохраняется высокая лихорадка и интоксикационный синдром, логично, что в такой ситуации понадобится помощь специалиста. Следует подчеркнуть, что для вирусного тонзиллофарингита клинически характерны также другие катаральные (ринорея, кашель) и системные симптомы (конъюнктивит, экзантема, энантема, диарея), в то время как при бактериальном тонзиллофарингите на первый план выходят внезапное начало заболевания с высокой лихорадки и выраженного интоксикационного синдрома, сильные боли в горле вплоть до невозможности приема жидкости и пищи, гиперемия и отек миндалин с наличием экссудата на их поверхности, увеличение и выраженная болезненность углочелюстных лимфатических узлов [16].
БГСА по-прежнему сохраняет 100% чувствительность к пенициллинам и цефалоспоринам [16], в то время как устойчивость к макролидам может варьировать в зависимости от региона от 5% до 23% и более (в Республике Беларусь оценивается в 8-12%) [17, 18]. F. necrophorum природно резистентна к макролидам и фторхинолонам, но в большинстве случаев чувствительна к полусинтетическим пенициллинам, цефалоспоринам, метронидазолу и клиндамицину [19].
У пациентов, не имеющих факторов риска носительства на слизистых ротоглотки S. aureus и признаков хронического тонзиллофарингита, оптимально в качестве средства первой линии назначать пероральные пенициллины или аминопенициллины (феноксиметилпенициллин, амоксициллин). В то же время наличие у пациента факторов риска носительства S. aureus (любая антибактериальная терапия в анамнезе в предшествующие 3 месяца, пребывание в закрытых организованных коллективах), не вызывающего острый тонзиллофарингит, но часто колонизирующего слизистые носо- и ротоглотки и почти всегда продуцирующего пенициллиназы, наличие хронического тонзиллофарингита, клиническая неэффективность терапии антибиотиками первой линии требует назначения либо ингибитор-защищенных пенициллинов (амоксициллин/клавуланат) либо пероральных цефалоспоринов II-III поколения (цефуроксим аксетил, цефдинир и другие) [20, 21].
По сравнению с амоксициллин/клавулановой кислотой цефалоспорины могут быть предпочтительны при лечении острого и обострении хронического тонзиллофарингита при непереносимости клавулановой кислоты (за счет своего прокинетического действия у части пациентов она обуславливает развитие гиперкинетического варианта диареи), а также при указании на аллергию на пенициллин и амоксициллин по II-IV типам в анамнезе. Кроме того, если для феноксиметилпенициллина, амоксициллина и амоксициллин/клавулановой кислоты по-прежнему рекомендуются только 10-дневные курсы терапии, позволяющие эффективно эрадицировать пиогенный стрептококк со слизистой ротоглотки, то для пероральных цефалоспоринов показана возможность сокращения курсов лечения острого тонзиллофарингита до 5 дней. Так, мета-анализ 5 рандомизированных клинических исследований с 1030 пациентами, продемонстрировал, что использование пятидневных курсов антибиотикотерапии пероральными цефалоспоринами (в том числе цефдиниром) не уступает десятидневным курсам терапии препаратами сравнения в отношении бактериологической эрадикации БГСА (ОР 1,96, 95% ДИ 0,96-2,22, р=0,008) [22]. Это может быть значимо для пациентов с сомнительной приверженностью к длительным курсам антибиотиков, так как, чем короче длительность лечения, тем выше вероятность, что пациент максимально исполнит рекомендации врача.
Острый средний отит – преимущественно бактериальное воспаление полости среднего уха, часто встречающееся у детей первых месяцев и лет жизни [23, 24]. Потенциальные внутричерепные осложнения, возникающие при неправильном ведении острого среднего отита (мастоидит, отогенный гнойный менингит, абсцессы мозга, тромбозы венозных синусов) являются жизнеугрожающими и могут сопровождаться в исходе тяжелыми неврологическими последствиями, что диктует необходимость быстрого и правильного лечения данного состояния.
Результаты систематического обзора 66 исследований за 1970-2014 г.г. четко показывают, что ключевыми возбудителями острого среднего отита являются пневмококк и гемофильная палочка, значительно реже встречается M. catarrhalis [25]. Кроме того, отмечена доминирующая роль пневмококка при развитии первого эпизода острого среднего отита, и превалирование над пневмококком гемофильной палочки в случае рецидивирующего состояния, а также у детей с хроническим экссудативным средним отитом и при неэффективности стартовой антибиотикотерапии.
Решение о целесообразности применения антибиотиков при остром среднем отите основано на оценке риска внутричерепных осложнений. Так, если возраст ребенка до 2 лет, либо ребенок старше, но заболевание изначально протекает с лихорадкой выше 38,0 °С, выраженной оталгией более суток, либо имеется двусторонний острый средний отит, рекомендуется немедленная инициация антибактериальной терапии.
В последние годы российскими коллегами опубликованы результаты очередного этапа крупного многоцентрового исследования оценки антибиотикорезистентности S. pneumoniae и H. influenzae ПЕГАС [26, 27, с. 317]. Так, среди бета-лактамов резистентностью к ампициллину и амоксициллину обладали до 14,3% штаммов S. pneumoniae, 11,0% оставались чувствительными при увеличенной экспозиции препарата, среди цефтриаксона полная устойчивость отмечена у 5,4% (15,6% – чувствительные при увеличенной экспозиции препарата) [26]. К макролидам резистентным являлся каждый третий изолят пневмококка. Среди изученных изолятов H. influenzae устойчивость к амоксициллину зафиксирована у 15,1%, в то время как к амоксициллину с клавулановой кислотой и цефалоспоринам III поколения – у 3,3% [27]. Учитывая невысокую резистентность пневмококка к бета-лактамным антибиотикам, при легком и среднетяжелом течении первого эпизода острого среднего отита и отсутствии указаний на прием антибиотиков в предшествующий месяц возможно применение амоксициллина. В случае тяжелого течения инфекции уже в первые дни заболевания, а также при наличии факторов риска резистентных к антибиотикам микроорганизмов (антибактериальная терапия в предшествующий месяц, рецидив или обострение хронической формы инфекции), неэффективности стартовой антимикробной терапии рекомендуется отдавать предпочтение амоксициллин/клавуланату или пероральным цефалоспоринам II-III поколения. Следует избегать применения макролидов при гемофильной этиологии острого среднего отита, так как они не обеспечивают эффективную эрадикацию возбудителя и не предотвращают рецидивы заболевания [28].
Цефдинир продемонстрировал высокую эффективность и безопасность при лечении острого гнойного среднего отита у 21 ребенка, находившегося на стационарном лечении в РНПЦ оториноларингологии г. Минска в 2019-2020 г.г. [29]. Назначение цефдинира сопровождалось значимой положительной клинической и отоскопической динамикой заболевания уже в первые три дня болезни с клиническим выздоровлением большинства пациентов на 5-й день лечения. Побочные эффекты лечения не фиксировались.
Острый риносинусит. Распространенное состояние в амбулаторной клинической практике, в 98% случаев имеющее вирусный генез [30]. Однако вовремя не распознанный бактериальный риносинусит, как и в случае с бактериальным отитом, может приводить с серьезным внутричерепным осложнениям (риногенный бактериальный менингит, тромбоз венозных синусов, абсцесс мозга, флегмона орбиты, мастоидит и другие). Рядом клинических руководств предложены 4 критерия, при наличии хотя бы одного из которых вероятность ринусинусита бактериальной этиологии у пациента существенно возрастает и требует назначения системной антибиотикотерапии. К данным критериям относятся: 1) затяжное течение риносинусита, даже при маловыраженной клинической симптоматике, более 10 дней; 2) острое начало с высокой лихорадки, явной интоксикации, сильных нарастающих по интенсивности лицевых болей, гнойного назального отделяемого уже в первые несколько дней заболевания; 3) «двойная болезнь»: повторное появление и усугубление клиники риносинусита на фоне первоначального улучшения проявлений острого респираторного заболевания; 4) любая отрицательная клиническая динамика на фоне проводимой патогенетической и симптоматической терапии риносинусита [30–32].
До 90% всех случаев бактериального риносинусита вызывают три ведущих возбудителя: Streptococcus pneumoniae, Haemophilus influenzae и Moraxella catarrhalis, до 10% приходиться на Streptococcus pyogenes, Staphylococcus aureus, Enterobacteriaceae и анаэробные микроорганизмы [32, 33]. Стартовым антибиотиком выбора для лечения острого бактериального риносинусита может по-прежнему считаться амоксициллин. В случае же наличия у пациента факторов риска инфицирования более резистентными возбудителями, в том числе продуцирующими бета-лактамазы (возраст до 2 лет или старше 65 лет, пребывание пациента до заболевания в организованных закрытых коллективах, предшествующие госпитализации или предшествующая антибактериальная терапия в ближайшие 1-3 месяца, наличие тяжелой сопутствующей патологии или иммуносупрессии, рецидивирующее течение инфекции), а также при тяжелом / прогрессирующем течении заболевания, несмотря на стартовую терапию амоксициллином, рекомендуется назначение ингибитор-защищенных полусинтетических пенициллинов или цефалоспоринов III поколения в течение 7-10 дней. Оценка эффективности цефдинира для лечения острого и рецидивирующего бактериального риносинусита проводилась профессором кафедры оториноларингологии ГУО «Белорусская медицинская академия последипломного образования» Л. Г. Петровой [34]. В исследование включены 22 пациента старше 18 лет, 9 из них – с диагнозом рецидивирующего бактериального риносинусита. При контрольном обследовании во время лечения уже на 3-й день от начала комплексной терапии с использованием цефдинира отмечено существенное улучшение состояния пациентов и быстрое снижение выраженности объективных симптомов заболевания по данным риноскопического исследования. Все пациенты, включенные в исследование, полностью завершили назначенный курс лечения цефдиниром и продемонстрировали клиническое излечение. Ни в одном случае не потребовалось выполнения пункции верхнечелюстного синуса. Нежелательных эффектов терапии не фиксировалось [34].
Следует обратить внимание, что респираторные фторхинолоны, которые на практике иногда назначаются в качестве антибиотиков первой линии при лечении риносинуситов как альтернатива бета-лактамным препаратам, должны на самом деле резервироваться для наиболее проблемных клинических ситуаций. Так, в 2016 г. FDA (США) выпустило предупреждение о том, что неблагоприятные побочные явления, связанные с приемом фторхинолонов (тендиниты, периферическая нейропатия, удлинение интервала QT и другие), в целом нивелируют их преимущества у пациентов с респираторными инфекциями, включая острый бактериальный риносинусит, и неосложненными инфекциями мочевыводящих путей. Поэтому в настоящее время респираторные фторхинолоны рекомендованы только в тех клинических случаях, когда не остается других более безопасных терапевтических альтернатив.
Инфекции кожи и мягких тканей, костей и суставов. Наиболее частыми возбудителями разнообразных инфекций кожи и мягких тканей, костей и суставов являются золотистый стафилококк (S. aureus) и пиогенный стрептококк (S. pyogenes). Длительное время для лечения данной группы инфекций использовались цефалоспорины I поколения (цефалексин, цефазолин) и полусинтетические антистафилококковые пенициллины (оксациллин, флуклоксациллин, диклоксациллин и другие), а также ингибитор-защищенные полусинтетические пенициллины. В то же время следует отметить, что в Республике Беларусь не зарегистрированы антистафилококковые пенициллины, а назначение цефалексина является субоптимальным вследствие короткого периода полувыведения последнего и, соответственно, необходимости в приеме препарата 4 раза в сутки, что сопровождается снижением приверженности пациента к лечению. Цефдинир выгодно отличается от всех пероральных цефалоспоринов сохраняющейся высокой активностью в отношении S. aureus, в том числе бета-лактамаз продуцирующих вариантов (многие цефалоспорины II-III поколения обладают меньшей антистафилококковой активностью, чем цефалоспорины I поколения), а также возможностью применения всей суточной дозы в 1-2 приема. При сравнении цефдинира в дозе 7 мг/кг каждые 12 ч у детей в возрасте от 6 месяцев до 12 лет с цефалексином в дозе 10 мг/кг 4 раза в сутки при инфекциях кожи и мягких тканей в двойном слепом рандомизированном исследовании частота микробиологической эрадикации патогенов и клинического выздоровления статистически значимо не отличались [35]. Аналогичные данные получены и в двойном слепом рандомизированном клиническом исследовании, сравнивавшем цефдинир 300 мг каждые 12 ч против цефалексина 500 мг каждые 6 часов, у взрослых пациентов с инфекциями кожи и мягких тканей [36]. Также доказана эффективность цефдинира для лечения инфекций кожи и мягких тканей при назначении всей его суточной дозы 600 мг 1 раз в день [37].
Инфекции мочевыводящих путей. Основные возбудители инфекций мочевыводящих путей – группа энтеробактерий, в частности, кишечная палочка (Escherichia coli, E. coli), этиологическая значимость которой в некоторых случаях достигает 95%. В опубликованном недавно крупном российском многоцентровом исследовании «ДАРМИС» (32 центра 24 городов России, 2017-2018 г.г.) у детей до 18 лет и взрослых с острыми и обострениями хронических внебольничных инфекций мочевыводящих путей доминирующим возбудителем также являлась E. coli, составляя от 67,2% и 74,6% при осложненных и неосложненных инфекциях мочевыводящих путей у взрослых и до 79,7% у детей [38]. Согласно результатам данной работы, чувствительность E. coli при неосложненных и осложненных инфекциях мочевыводящих путей у взрослых к ципрофлоксацину отмечалась на уровне 72,1% и 54,1%, к амоксициллину / клавуланату – 60,9% и 56,7%, к цефалоспоринам III поколения – 82,8% и 69,5% (на примере цефиксима), соответственно. Высокой микробиологической активностью характеризовались фосфомицин и нитрофурантоин (практически 100% чувствительность), широко назначаемые в амбулаторной практике, однако данные антибиотики мало применимы при локализации инфекции мочевыводящих путей выше уровня мочевого пузыря, так как не создают выраженных концентраций в паренхиме почек. Показания для применения цефдинира при инфекциях мочевыводящих путей могут быть следующими [39]:
- неэффективность препаратов первого ряда;
- применение фосфомицина или нитрофуранов для лечения предыдущего эпизода инфекции мочевыводящих путей в предшествующие 30 дней;
- рецидивирующее течение заболевания;
- наличие у пациента противопоказаний для использования фторхинолонов и фосфомицина;
- неосложненный пиелонефрит.
Обострение хронической обструктивной болезни легких (ХОБЛ). Наиболее частыми причинами обострений ХОБЛ являются бактериальные, вирусные респираторные инфекции и атмосферные поллютанты. Среди бактерий наибольшую роль играют H. influenzae, S. pneumoniae и M. catarrhalis; у части пациентов могут также встречаться энтеробактерии и синегнойная палочка. Выбор антибактериальной терапии при лечении обострения ХОБЛ зависит от ряда факторов: возраста пациента, степени сохранности бронхиальной проходимости, предшествующих обострений, их частоты и тяжести, сопутствующих заболеваний и проводимой ранее антибиотикотерапии [40]. Так, при редких обострениях легкой и средней степени тяжести, сохраненной бронхиальной проходимости (объем форсированного выдоха за первую секунду >50%) возможно применение амоксициллина или макролидов, в качестве препаратов второй линии – амоксициллина/клавуланата, пероральных цефалоспоринов II-III поколения. У пациентов с легким и среднетяжелым течением, но факторами риска полирезистентных респираторных возбудителей (возраст старше 65 лет, сопутствующие сердечно-сосудистые заболевания, сахарный диабет (СД), печеночная и/или почечная недостаточность, частые обострения в течение года), а также при тяжелом течении обострения ХОБЛ должны назначаться ингибитор-защищенные пенициллины или пероральные цефалоспорины III поколения, в том числе цефдинир.
Внебольничная пневмония (ВП) – это острое инфекционное (преимущественно бактериальное) заболевание, характеризующееся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации, развивающееся вне стационара, либо в первые 48 часов от момента госпитализации [41, 42].
К наиболее частым возбудителям ВП относятся Streptococcus pneumoniae (30-50% случаев ВП), Mycoplasma pneumoniae и Chlamydophila pneumoniae (20-30% случаев ВП суммарно), реже ВП вызывают Haemophilus influenzae (у пациентов с хроническим бронхитом, ХОБЛ, курильщиков); респираторные вирусы; Klebsiella pneumoniae и Escherichia coli (у лиц с хроническими сопутствующими заболеваниями, такими как СД, хроническая сердечная недостаточность (ХСН), алкоголизм, цирроз печени и при тяжелой ВП); Staphylococcus aureus (у пожилых, внутривенных (в/в) наркоманов, на фоне или после перенесенного гриппа); Pseudomonas aeruginosa (у пациентов с муковисцидозом, бронхоэктазами, предшествующей длительной антибактериальной терапией, при лечении системными глюкокортикостероидами); Legionella pneumophila (при контакте с кондиционерами, увлажнителями воздуха, системами охлаждения воды, недавнем (≤2 недели) морским путешествием/проживанием в гостинице) [41-48].
Стартовую антибактериальную терапию при ВП назначают эмпирически с учетом имеющихся у пациента сопутствующих заболеваний и факторов риска (ФР), определяющих спектр возможных возбудителей и профиль антибиотикорезистентности, и в как можно более короткие сроки (не позднее 8 ч с момента верификации диагноза) с целью улучшения прогноза заболевания [41, 42, 46-49].
Амбулаторным пациентам с ВП назначаются пероральные лекарственные формы антибиотиков, имеющие высокую биодоступность и, в отличие от парентеральных антибиотиков, не требующие дополнительных затрат на введение и не создающие риск развития постинъекционных осложнений [41, 42, 49]. Не установлено доказанных преимуществ парентеральных антибиотиков перед пероральными при амбулаторном лечении ВП [41, 50, 51].
Амбулаторные пациенты с нетяжелой ВП делятся на две группы:
1-я группа включает пациентов без сопутствующих заболеваний, не принимавших за последние 3 месяца антимикробные препараты ≥2 дней и не имеющих других ФР инфицирования редкими и/или полирезистентными возбудителями (ПРВ): пребывание в доме престарелых или других учреждениях длительного ухода, наличие госпитализаций по любому поводу в течение ≥ 2 суток в предшествующие 90 дней, в/в инфузионная терапия, наличие сеансов диализа или лечение ран в домашних условиях в предшествующие 30 дней [41, 42, 48, 49, 52]. Антибиотиком выбора у пациентов этой группы является амоксициллин, альтернатива – макролиды [41, 42, 49, 52]. Назначение макролидов в качестве препаратов первой линии не рекомендуется ввиду возможной неэффективности лечения из-за роста устойчивости к ним S. pneumoniae [41, 53, 54]. Макролиды в качестве стартовой терапии ВП могут применяться при невозможности использовать аминопенициллины (индивидуальная непереносимость, аллергические реакции немедленного типа на β-лактамы в анамнезе), а также при наличии клинических/эпидемиологических данных, указывающих на то, что ВП вызвана атипичными возбудителями (M. pneumoniae или C. pneumoniae) [41, 42, 49, 52]. Несмотря на определенную роль M. pneumoniae и C. pneumoniae в этиологии ВП, рутинное назначение комбинации β-лактамного АБ и макролида в амбулаторной практике не показано, так как в настоящее время нет доказательных данных, что такая комбинация улучшает исходы лечения, повышая риск нежелательных лекарственных реакций и приводя к росту антибиотикорезистентности [41]. В руководстве по ВП Американского торакального общества и Американского общества по инфекционным болезням, опубликованном в 2019 году, пациентам этой группы рекомендуется назначение амоксициллина или доксициллина или макролида (если локальный уровень резистентности пневмококка к макролидам менее 25%) [48].
Во 2-ю группу входят пациенты с нетяжелой ВП и сопутствующими заболеваниями (ХОБЛ, СД, ХСН, хроническая болезнь почек, цирроз печени, алкоголизм, наркомания, истощение) и/или принимавшие за последние 3 месяца антимикробные препараты ≥2 дней и/или имеющие другие ФР инфицирования редкими и/или ПРВ [41, 42, 48, 49, 52]. Антибиотики выбора для пациентов этой группы – ингибиторозищищенные аминопенициллины, альтернатива – респираторные фторхинолоны (РФХ) или цефалоспорины III поколения [41, 42, 49, 52]. В руководстве по ВП Американского торакального общества и Американского общества по инфекционным болезням 2019 года в качестве антибиотиков выбора указываются ингибиторозищищенные аминопенициллины или цефалоспорины II-III поколений в комбинации с макролидом или доксициклином, а в качестве альтернативы – РФХ [48].
Цефалоспорин III поколения цефдинир в мировой клинической практике применяется уже многие годы [55, 56]. Так, еще в 1997 году были опубликованы результаты многоцентрового двойного слепого плацебо-контролируемого исследования, в котором сравнивалась эффективность и безопасность цефдинира и цефаклора при лечении ВП [55]. Исследование включало 690 пациентов с ВП, которые в течение 10 дней получали либо цефдинир (n = 347) по 300 мг 2 раза в день, либо цефаклор (n = 343) по 500 мг 3 раза в день [55]. В ходе исследования было показано, что статистически значимых различий между группами не было, как в отношении адекватного клинического ответа (выздоровление, улучшение), так и в частоте микробиологической эрадикации возбудителя (92% и 93%, соответственно) [55]. Был сделан вывод, что цефдинир является эффективным и безопасным антибиотиком при лечении нетяжелых ВП [55].
В многоцентровом двойном слепом плацебо-контролируемом исследовании, включавшем 548 пациентов с обострением хронического бронхита, было продемонстрировано, что 5-дневный курс лечения цефдиниром также эффективен и безопасен, как 10-дневный курс лечения цефпрозилом. Более того, 5-дневный курс лечения цефдиниром ассоциировался с лучшими клиническими исходами (частота клинического выздоровления составляла 80% и 72%, соответственно) при эквивалентном микробиологическом исходе (частота эрадикации возбудителя 79% и 81%, соответственно) по сравнению с 10-дневным курсом лечения цефпрозилом [56].
Для лечения нетяжелой ВП цефдинир применяется как у взрослых, так и у детей, начиная с 6 месяцев жизни [55, 57-60]. Для детей созданы специальные лекарственные формы. При ВП у ранее здоровых детей в возрасте до 5 лет с не I типом гиперчувствительности к пенициллинам, оральные цефалоспорины II-III поколений, включая цефдинир, рассматриваются как препараты выбора [58-60].
На сегодняшний день текущие клинические руководства определяют цефалоспорины III поколения как альтернативные эмпирические средства для лечения ВП, применяемые при неэффективности антибиотиков первой линии, либо как препараты первого выбора при наличии противопоказаний или ограничений для назначения аминопенициллинов, в том числе защищенных, и макролидов.
Клинический случай
Пациентка К., 38 лет. Жалобы на повышение температуры тела до 38,50С, озноб, кашель с отхождением мокроты желтого цвета, одышку при умеренной физической нагрузке, выраженную потливость, слабость. Заболела остро после переохлаждения. Болеет пятый день. Лечилась жаропонижающими. Курит в течение 20 лет по 15 сигарет в день (индекс курящего человека (ИКЧ)=15 пачка/лет), алкоголем не злоупотребляет. Работает продавцом. Работа связана с воздействием сквозняков и переохлаждениями. В анамнезе хронический бронхит в течение 5 лет (обострения 1-2 раза в год, последнее обострение 5 месяцев назад на фоне ОРВИ, лечилась амбулаторно азитромицином). Аллергоанамнез отягощен – аллергия на пенициллины (сыпь).
Данные физикального обследования: t=37,80С, ЧСС 88 уд/мин, АД 120/70 мм рт. ст. ЧД 20/мин. SpО2 96%. Телосложение правильное. Сознание ясное. Положение активное. Кожные покровы чистые, обычной окраски, влажные. Периферические лимфоузлы не увеличены. При перкуссии легких справа ниже угла лопатки отмечается укорочение перкуторного звука, слева – ясный легочный звук. При аускультации легких справа в нижних отделах дыхание ослаблено, в этой области выслушиваются влажные мелкопузырчатые хрипы; слева дыхание везикулярное; единичные сухие хрипы с обеих сторон. Тоны сердца ритмичные, чистые. Живот мягкий, безболезненный. Печень у края реберной дуги. Стул и мочеиспускание не нарушены. Периферических отеков нет.
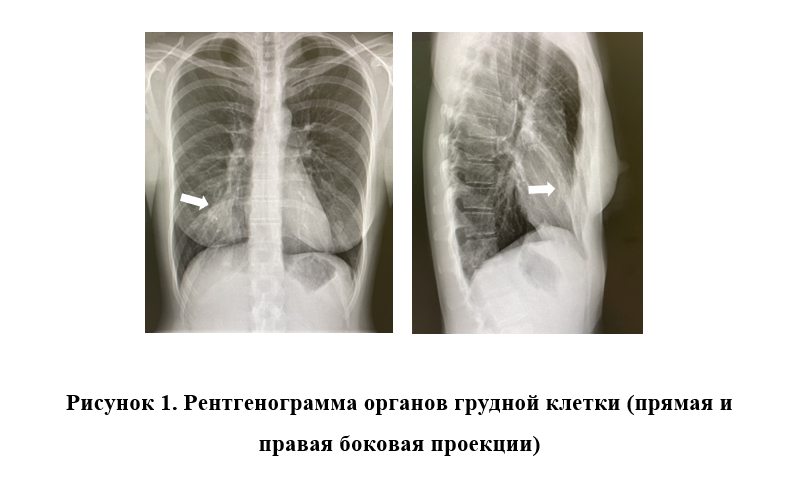
Рентгенограмма органов грудной клетки (прямая и правая боковая проекции) (рисунок 1): Легочный рисунок неравномерно усилен, больше справа в нижних отделах, инфильтрация легочной ткани в S5 справа. Корни легких не расширены, структурны. Заключение: пневмония в средней доле (S5) справа.
Общий анализ крови: Эритроциты 4,5х1012/л, гемоглобин 138 г/л, лейкоциты 11х109/л, палочкоядерные 8%, нейтрофилы 78%, эозинофилы 1%, лимфоциты 11%, моноциты 2%, СОЭ 28 мм/ч.
Биохимический анализ крови: СРБ 35 мг/л, билирубин 18 ммоль/л, АЛТ 28 ммоль/л, АСТ 25 ммоль/л, мочевина 6,8 ммоль/л, креатинин 0,071 ммоль/л, мочевая кислота 0,28 ммоль/л, глюкоза 4,8 ммоль/л, общий белок 71 ммоль/л, альбумин 45 ммоль/л, холестерин 4,5 ммоль/л, триглицериды 1,6 ммоль/л, ЛПНП 2,9 ммоль/л, ЛПВП – 1,4 ммоль/л, калий 4,5 ммоль/л, натрий 140 ммоль/л, хлориды 104 ммоль/л, кальций 2,3 ммоль/л.
Общий анализ мочи: цвет соломенно-желтый, удельный вес 1020, белка, сахара нет, лейкоциты 0-1 в поле зрения.
Клинический диагноз: Основное заболевание: Внебольничная пневмония в средней доле (S5) справа, нетяжелое течение. Фоновое заболевание: Хронический слизисто-гнойный бронхит, фаза обострения. Осложнения: ДН0.
Лечение: Режим амбулаторный (пациентка временно нетрудоспособна). Обильное теплое питье. Прекращение курения.
Пациентке были назначены: Цефдинир в виде лекарственного препарата Адицеф® (Фармакар, ПЛС) по 1 капсуле (300 мг) 2 раза в день вне зависимости от приема пищи; Амброксол по 1 таблетке (30 мг) 3 раза в день после еды.
Телефонный контакт на следующий день
Самочувствие пациентки без ухудшения. Сохраняется повышение температуры тела до 38ºС, снижающееся после приема жаропонижающих, кашель с отхождением желтой мокроты в умеренном количестве, потливость, слабость. Одышка при ходьбе по квартире не беспокоит. Рекомендованное лечение принимает, побочных эффектов не отмечает.
Через 72 ч от начала лечения Адицефом была проведена оценка эффективности терапии.
Пациентка отметила улучшение самочувствия. Температура тела снизилась до 37,0-37,20С; кашель стал реже, ночью не беспокоит; мокрота светло-желтая, в умеренном количестве, отходит хорошо; одышка не беспокоит; слабость, потливость уменьшились.
Данные физикального обследования: t=37,10С, ЧСС 84 уд/мин, АД 120/80 мм рт.ст. ЧД 18/мин. SpО2 97%. Сознание ясное. Положение активное. Кожные покровы чистые, обычной окраски, влажные. Периферические лимфоузлы не увеличены. При перкуссии легких справа ниже угла лопатки отмечается укорочение перкуторного звука, слева – ясный легочный звук. При аускультации легких справа ниже угла лопатки дыхание ослаблено, в этой области выслушиваются влажные мелкопузырчатые хрипы, слева дыхание везикулярное. Тоны сердца ритмичные, чистые. Живот мягкий, безболезненный. Печень у края реберной дуги. Стул и мочеиспускание не нарушены. Периферических отеков нет.
Учитывая положительную динамику (уменьшение выраженности интоксикации и респираторных симптомов, исчезновение сухих хрипов при аускультации легких), было рекомендовано продолжить лечение и добавить дыхательную гимнастику.
Через 7 дней лечения Адицефом самочувствие пациентки значительно улучшилось. Температура тела нормализовалась; одышка, слабость, потливость не беспокоили. Сохранялся нечастый кашель с отхождением густой мокроты белого цвета. Каких-либо побочных эффектов во время лечения Адицефом пациентка не отмечала.
Данные физикального обследования: t=36,80С, ЧСС 78 уд/мин, АД 120/80 мм рт.ст. ЧД 18/мин. SpО2 98%. Сознание ясное. Положение активное. Кожные покровы чистые, обычной окраски. Периферические лимфоузлы не увеличены. При перкуссии легких ясный легочный звук. При аускультации легких дыхание везикулярное, справа ниже угла лопатки небольшое количество влажных мелкопузырчатых хрипов. Тоны сердца ритмичные, чистые. Живот мягкий, безболезненный. Печень у края реберной дуги. Стул и мочеиспускание не нарушены. Периферических отеков нет.
Общий анализ крови через 7 дней: Эритроциты 4,3х1012/л, гемоглобин 132 г/л, лейкоциты 7,5х109/л, палочкоядерные 4%, нейтрофилы 68%, эозинофилы 2%, лимфоциты 16%, моноциты 10%, СОЭ 35 мм/ч.
Биохимический анализ крови через 7 дней: СРБ 7 мг/л, билирубин 20 ммоль/л, АЛТ 30 ммоль/л, АСТ 28 ммоль/л, мочевина 7,0 ммоль/л, креатинин 0,069 ммоль/л, мочевая кислота 0,27 ммоль/л, глюкоза 5,1 ммоль/л, общий белок 68 ммоль/л, альбумин 39 ммоль/л, холестерин 4,0 ммоль/л, калий 4,2 ммоль/л, натрий 142 ммоль/л, хлориды 106 ммоль/л, кальций 2,28 ммоль/л.
Посев мокроты на флору и чувствительность к антибиотикам выполнялся в связи с наличием у пациентки хронического бронхита и предшествующих курсов антибиотикотерапии. Результат был получен на 5-й день лечения Адицефом: выделенный микроорганизм – Haemophilus influenzae 105 КОЕ/мл, чувствителен к амоксициллину, амоксициллину/клавуланату, цефотаксиму, цефтриаксону, цефиксиму, ципрофлоксацину, левофлоксацину, моксифлоксацину, тетрациклину; устойчив к азитромицину, кларитромицину, ко-тримоксазолу.
Через 7 дней лечения было принято решение завершить курс терапии Адицефом, поскольку у пациентки имелись все критерии достаточности антибиотикотерапии, служащие обоснованием ее отмены: стойкое снижение температуры тела (t≤37,2ºС) в течение не менее 48 ч; отсутствие интоксикационного синдрома; частота дыхания <20/мин (у пациентов без хронической дыхательной недостаточности); отсутствие гнойной мокроты; количество лейкоцитов в крови <10х109/л, нейтрофилов <80%, юных форм <6% [41, 46-49]. Кроме этого, у пациентки отмечался хороший ответ на стартовую антибиотикотерапию Адицефом при оценке ее эффективности через 72 часа.
Было рекомендовано продолжить мукорегулирующую терапию амброксолом до 14 дней и выполнять дыхательную гимнастику.
Через 14 дней лечения самочувствие пациентки значительно улучшилось. Температура тела нормализовалась; одышка, слабость, потливость не беспокоили. Сохранялся редкий кашель с отхождением небольшого количества прозрачной мокроты.
Данные физикального обследования: t=36,70С, ЧСС 72 уд/мин, АД 120/80 мм рт.ст. ЧД 18/мин. SpО2 98%. Сознание ясное. Положение активное. Кожные покровы чистые, обычной окраски. Периферические лимфоузлы не увеличены. При перкуссии легких ясный легочный звук. При аускультации легких дыхание везикулярное. Тоны сердца ритмичные, чистые. Живот мягкий, безболезненный. Печень у края реберной дуги. Стул и мочеиспускание не нарушены. Периферических отеков нет.
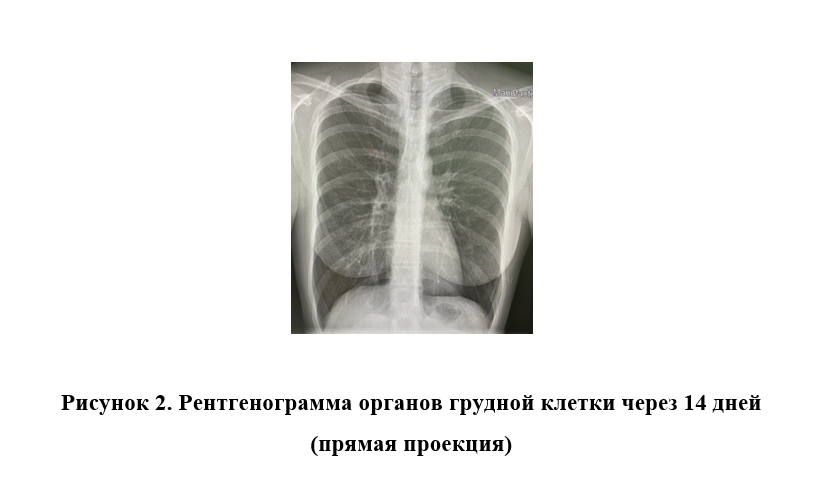
Рентгенограмма ОГК через 14 дней (рисунок 2): инфильтрация легочной ткани в S5 справа разрешилась, в этой области отмечается усиление легочного рисунка.
Контрольный посев мокроты на флору и чувствительность к антибиотикам после завершения курса лечения Адицефом: посев роста не дал.
Пациентке были даны следующие рекомендации:
- Динамическое наблюдение по пневмонии в течение 6 месяцев с осмотром через 1, 3 и 6 месяцев;
- контроль общего анализа крови и уровня СРБ через 1 месяц;
- спирограмма с салбутамолом с целью проведения дифференциальной диагностики хронического бронхита с ХОБЛ, учитывая длительный стаж курения (ИКЧ = 15 пачка/лет).
Комплекс рекомендованных профилактических мероприятий включал прекращение курения; вакцинацию от гриппа, COVID-19 и пневмококковой инфекции; выполнение дыхательной гимнастики; исключение переохлаждений и пребывания на сквозняках.
В представленном клиническом случае 7-дневный курс лечения Адицефом у пациентки с внебольничной пневмонией, вызванной Haemophilus influenzae, и хроническим бронхитом оказался успешным, как с точки зрения клинико-рентгенологического исхода (выздоровление, разрешение инфильтрации), так и в отношении микробиологической эрадикации возбудителя. Каких-либо побочных эффектов во время лечения Адицефом не отмечалось.
Таким образом, цефдинир как современный представитель цефалоспоринов III поколения, является высокоэффективным антибиотиком при инфекциях респираторного тракта, инфекциях кожи и мягких тканей, инфекциях мочевыводящих путей с хорошим профилем безопасности и приемлемой стоимостью. В то же время польза от его назначения будет максимальной лишь в определенных клинических ситуациях, и практикующему врачу крайне важно в них ориентироваться, чтобы «не потерять» очередной антибактериальный препарат для современной амбулаторной клинической практики.
Статья размещена в журнале Медицинские новости № 10.2021
Литература
- Acute respiratory symptoms in adults in general practice / C.Y. Hong [et al.] // Fam. Pract. – 2004. – Vol. 21, № 3. – P. 317–323.
- Teng, C.L. Antibiotic prescribing for upper respiratory tract infections in the Asia-Pacific region: A brief review / C.L. Teng // Malays. Fam. Physician Off. J. Acad. Fam. Physicians Malays. – 2014. – Vol. 9, № 2. – P. 18–25.
- Cantrell, R. Antibiotic prescribing in ambulatory care settings for adults with colds, upper respiratory tract infections, and bronchitis / R. Cantrell, A.F. Young, B.C. Martin // Clin. Ther. – 2002. – Vol. 24, № 1. – P. 170–182.
- Antibiotic prescribing for adults in ambulatory care in the USA, 2007-09 / D.J. Shapiro [et al.] // J. Antimicrob. Chemother. – 2014. – Vol. 69, № 1. – P. 234–240.
- Appropriate international measures for outpatient antibiotic prescribing and consumption: recommendations from a national data comparison of different measures / S. Coenen [et al.] // J. Antimicrob. Chemother. – 2014. – Vol. 69, № 2. – P. 529–534.
- Guay, D.R. Cefdinir: an expanded-spectrum oral cephalosporin / D.R. Guay // Ann. Pharmacother. – 2000. – Vol. 34, № 12. – P. 1469–1477.
- Antibiotic use in acute upper respiratory tract infections / R. Zoorob [et al.] // Am. Fam. Physician. – 2012. – Vol. 86, № 9. – P. 817–822.
- The rational clinical examination. Does this patient have strep throat? / M.H. Ebell [и др.] // JAMA. – 2000. – Vol. 284, № 22. – P. 2912–2918.
- Clinical practice guideline for the diagnosis and management of group A streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America / S.T. Shulman [et al.] // Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. – 2012. – Vol. 55, № 10. – P. e86–102.
- A six-month audit of the isolation of Fusobacterium necrophorum from patients with sore throat in a district general hospital / J.A. Amess [et al.] // Br. J. Biomed. Sci. – 2007. – Vol. 64, № 2. – P. 63–65.
- Jensen, A. Detection of Fusobacterium necrophorum subsp. funduliforme in tonsillitis in young adults by real-time PCR / A. Jensen, L. Hagelskjaer Kristensen, J. Prag // Clin. Microbiol. Infect. Off. Publ. Eur. Soc. Clin. Microbiol. Infect. Dis. – 2007. – Vol. 13, № 7. – P. 695–701.
- The aetiology of pharyngotonsillitis in adolescents and adults - Fusobacterium necrophorum is commonly found / K. Hedin [et al.] // Clin. Microbiol. Infect. Off. Publ. Eur. Soc. Clin. Microbiol. Infect. Dis. – 2015. – Vol. 21, № 3. – P. 263.e1–7.
- A systematic review of Fusobacterium necrophorum-positive acute tonsillitis: prevalence, methods of detection, patient characteristics, and the usefulness of the Centor score / T.E. Klug [et al.] // Eur. J. Clin. Microbiol. Infect. Dis. Off. Publ. Eur. Soc. Clin. Microbiol. – 2016. – Vol. 35, № 12. – P. 1903–1912.
- Tonsillar colonisation of Fusobacterium necrophorum in patients subjected to tonsillectomy / H. Björk [et al.] // BMC Infect. Dis. – 2015. – Vol. 15 – P. 264.
- Riordan, T. Human infection with Fusobacterium necrophorum (Necrobacillosis), with a focus on Lemierre’s syndrome / T. Riordan // Clin. Microbiol. Rev. – 2007. – Vol. 20, № 4. – P. 622–659.
- Kociolek, L.K. In the clinic. Pharyngitis / L.K. Kociolek, S.T. Shulman // Ann. Intern. Med. – 2012. – Vol. 157, № 5. – P. ITC3-1-ITC3-16.
- Community-based surveillance in the united states of macrolide-resistant pediatric pharyngeal group A streptococci during 3 respiratory disease seasons / R.R. Tanz [et al.] // Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. – 2004. – Vol. 39, № 12. – P. 1794–1801.
- Seven-year surveillance of emm types of pediatric Group A streptococcal pharyngitis isolates in Western Greece / G.A. Syrogiannopoulos [et al.] // PloS One. – 2013. – Т. 8, № 8. – P. e71558.
- The role of Fusobacterium necrophorum in pharyngotonsillitis - A review / K. Holm [et al.] // Anaerobe. – 2016. – Vol. 42 – P. 89–97.
- Penicillin failure in streptococcal tonsillopharyngitis: causes and remedies / M.E. Pichichero [et al.] // Pediatr. Infect. Dis. J. – 2000. – Vol. 19, № 9. – P. 917–923.
- Pichichero, M.E. Systematic review of factors contributing to penicillin treatment failure in Streptococcus pyogenes pharyngitis / M.E. Pichichero, J.R. Casey // Otolaryngol. Head Neck Surg. Off. J. Am. Acad. Otolaryngol.-Head Neck Surg. – 2007. – Vol. 137, № 6. – P. 851–857.
- Pichichero, M.E. Bacterial eradication rates with shortened courses of 2nd- and 3rd-generation cephalosporins versus 10 days of penicillin for treatment of group A streptococcal tonsillopharyngitis in adults / M.E. Pichichero, J.R. Casey // Diagn. Microbiol. Infect. Dis. – 2007. – Vol. 59, № 2. – P. 127–130.
- Atkinson, H. Acute otitis media / H. Atkinson, S. Wallis, A.P. Coatesworth // Postgrad. Med. – 2015. – Vol. 127, № 4. – P. 386–390.
- Dickson, G. Acute otitis media / G. Dickson // Prim. Care. – 2014. – Vol. 41, № 1. – P. 11–18.
- Predominant Bacteria Detected from the Middle Ear Fluid of Children Experiencing Otitis Media: A Systematic Review / C.C. Ngo [et al.] // PloS One. – 2016. – Vol. 11, № 3. – P. e0150949.
- Антибиотикорезистентность клинических штаммов Streptococcus pneumoniae в России: результаты многоцентрового эпидемиологического исследования «ПеГАС 2014-2017» / Н.В. Иванчик [и др.] // Клин. микробиол. антимикроб. химиотер. – 2019. – Т. 21, № 3. – С. 230–237.
- Антибиотикорезистентность клинических штаммов Haemophilus influenzae в России: результаты многоцентрового эпидемиологического исследования ПЕГАС (2014–2017 гг.) / Н.В. Иванчик [и др.] // Клин. микробиол. антимикроб. химиотер. – 2019. – №4. – С. 317–323.
- Increased clinical failures when treating acute otitis media with macrolides: a meta-analysis / J.D. Courter [et al.] // Ann. Pharmacother. – 2010. – Vol. 44, № 3. – P. 471–478.
- Еременко, Ю.Е. Исследование эффективности и безопасности цефдинира в лечении острого гнойного среднего отита у детей [Электронный ресурс]. - Режим доступа: https://pharmacare.by/publications/otorhinolaryngology/issledovanie-effektivnosti-i-bezopasnosti-cefdinira-v-lechenii-ostrogo-gnojnogo-srednego-otita-u-detej.html. - Дата доступа: 25.07.2021.
- EPOS 2012: European position paper on rhinosinusitis and nasal polyps 2012. A summary for otorhinolaryngologists / W.J. Fokkens [et al.] // Rhinology. – 2012. – Vol. 50, № 1. – P. 1–12.
- Principles of appropriate antibiotic use for treatment of nonspecific upper respiratory tract infections in adults: background / R. Gonzales [et al.] // Ann. Intern. Med. – 2001. – Vol. 134, № 6. – P. 490–494.
- IDSA clinical practice guideline for acute bacterial rhinosinusitis in children and adults / A.W. Chow [et al.] // Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. – 2012. – Vol. 54, № 8. – P. e72–e112.
- Возбудители острого бактериального риносинусита. Результаты многоцентрового микробиологического исследования SSSR / Л.С. Страчунский [и др.] // Клин. микробиол. антимикроб. химиотер. – 2005. – №4. – С. 337–349.
- Петрова, Л.Г. Современные принципы лечения острого риносинусита [Электронный ресурс]. - Режим доступа: https://pharmacare.by/publications/otorhinolaryngology/sovremennye-principy-lecheniya-ostrogo-rinosinusita.html. - Дата доступа: 25.07.2021.
- Study of use of cefdinir versus cephalexin for treatment of skin infections in pediatric patients. The Cefdinir Pediatric Skin Infection Study Group. / K.J. Tack [et al.] // Antimicrob. Agents Chemother. – 1997. – Vol. 41, № 4. – P. 739–742.
- Cefdinir versus cephalexin for the treatment of skin and skin-structure infections / K.J. Tack [et al.] // Clin. Ther. – 1998. – Vol. 20, № 2. – P. 244–256.
- Effectiveness of oral cefdinir once daily versus oral cephalexin 4 times daily for the treatment of uncomplicated skin and skin structure infections // J. Am. Acad. Dermatol. – 2007. – Vol.56, № – P. AB121.
- Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «ДАРМИС-2018» / И.С. Палагин [и др.] // Клин. микробиол. антимикроб. химиотер. – 2019. – Т. 21, № 2.
- Козлов, Р.С. Пероральные цефалоспорины III поколения при внебольничных инфекциях мочевых путей: современные аспекты применения / Р.С. Козлов, И.С. Палагин, А.В. Голуб // Клин. микробиол. антимикроб. химиотер. – 2019. – Т. 21, № 3.
- Голуб, А.В. Пероральные цефалоспорины III поколения в амбулаторной клинической практике: современные аспекты применения / А.В. Голуб // Клин. микробиол. антимикроб. химиотер. – 2015. – Т. 17, № 1.
- Внебольничная пневмония у взрослых: клинические рекомендации МЗ РФ / Российское респираторное общество, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии, 2019. – 97 с.
- Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике (пособие для врачей) / А.Г. Чучалин [и др.] // Клин микробиол антимикроб химиотер. – 2010. – №12. – С. 186–225.
- The aetiology and antibiotic management of community-acquired pneumonia in adults in Europe: a literature review / A. Torres [et al.] // Eur J Clin Microbiol Infect Dis. – 2014. – Vol. 33, №7. – P. 1065–1079.
- Etiology of community-acquired pneumonia: increased microbiological yield with new diagnostic methods / N. Johansson [et al.] // Clin Infect Dis. – 2010. – Vol. 50. – P. 202–209.
- Структура бактериальных возбудителей внебольничной пневмонии в многопрофильных стационарах г. Смоленска / С.А. Рачина [и др.] // Пульмонология. – 2011, №1. – C. 5–18.
- Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community Acquired Pneumonia in Adults / L.M. Mandell [et al.] // Clin Infect Dis. – 2007. – Vol. 44, Suppl 2. – P. S27–72.
- Management of community-acquired pneumonia in immunocompetent adults: updated Swedish guidelines 2017 / S. Athlin [et al.] // Infect Dis (Lond). – 2018. – Vol. 50, №4. – P. 247–272.
- Diagnosis and treatment of adults with community-acquired pneumonia an official clinical practice guideline of the American Thoracic Society and Infectious Diseases Society of America / J.P. Metlay [et al.] // Am J Respir Crit Care Med. – 2019. – Vol. 200, №7. – P. e45–e67.
- British Thoracic Society guidelines for the management of community-acquired pneumonia in adults – update 2009 / W.S. Lim [et al.] // – 2009. – Vol. 64, Suppl III. – P. iii1-55.
- Oral gemifloxacin versus sequential therapy with intravenous ceftriaxone/oral cefuroxime with or without a macrolide in the treatment of patients hospitalized with community-acquired pneumonia: a randomized, open-label, multicenter study of clinical efficacy and tolerability / H. Lode [et al.] // Clin Ther. – 2002. – Vol. 24. – P. 1915–1936.
- Zuck, P. Efficacy and tolerance of cefpodoxime proxetil compared with ceftriaxone in vulnerable patients with bronchopneumonia / P. Zuck, Y. Rio, F. Ichou // J Antimicrob Chemother. – 1990. – Vol. 26S. – P. 71–77.
- South African guideline for the management of community-acquired pneumonia in adults / T. H. Boyles [et al.] // J Torac Dis. – 2017. – Vol. 9, №6. – P. 1469–1502.
- Failure of macrolide antibiotic treatment in patients with bacteremia due to erythromycin-resistant Streptococcus pneumonia / J.R. Lonks [et al.] // Clin Infect Dis. – 2002. – Vol. 35. – P. 556–564.
- Macrolide resistance in bacteremic pneumococcal disease: implications for patient management / N. Daneman [et al.] // Clin Infect Dis. – 2006. – Vol. 43. – P. 432–438.
- Comparison of cefdinir and cefaclor in treatment of community-acquired pneumonia / M. Drehobl [et al.] / Antimicrob. Agents Chemother. – 1997. – Vol. 41, № 7. – P. 1579–1583.
- Comparison of a 5 day regimen of Cefdinir with a 10 day regimen of cefprozil for treatment of acute exacerbations of chronic bronchitis / C.M. Fogarti [et al.] // J Antimicrob Chemother. – 2000. – Vol. 45. – P. 851–858.
- Chacón Jiménez, N.K. Antibiotic therapy in community acquired pneumonia / N.K. Chacón Jiménez, J.P. Jiménez Bermúdez, K.D. Carballo Solís // Rev. Costarricense de Salud Pública. – 2019. – Vol. 28, №2. – P. 141–154.
- Barson, W. Community-acquired pneumonia in children: outpatient treatment. In: Post TW, ed. UpToDate. Waltham, MA, 2018.
- Leung, A.K. Community-Acquired Pneumonia in Children / A.K. Leung, A.H. Wong, K.L. Hon // Recent Patents on Inflammation & Allergy Drug Discovery. – 2018. – Vol. 12, №2. – P. 136–144.
Hospital outcomes associated with guideline-recommended antibiotic therapy for pediatric pneumonia / J. Thomson [et al.] // Journal of Hospital Medicine. – 2015. – Vol 10, №1. – P. 13–18.