Публикации
Информация для специалистов
Информация предназначена для специалистов здравоохранения и не может быть использована иными лицами, в том числе для замены консультации с врачом и для принятия решения о применении данных препаратов!
Макролиды: препараты выбора или альтернатива в терапии пневмококковых инфекций
Макролиды: препараты выбора или альтернатива в терапии пневмококковых инфекций
После внедрения технологий синтеза и промышленного производства пенициллина в 40-е гг., началась «золотая эра» в развитии химиотерапии, сопровождающаяся открытием и созданием новых классов и групп антимикробных препаратов.
Их широкое применение, наряду с улучшением санитарно-гигиенической обстановки, широкого внедрения иммунизации привело к значительному снижению летальности от инфекционных заболеваний. Однако эти достижения в настоящее время находятся под серьезной угрозой вследствие появления и распространения антибиотикорезистентных бактерий, причем немалая роль в этом принадлежит пневмококкам.
В настоящее время доказанной является роль S. pneumoniae в этиологии различных инфекций. С клинической точки зрения выделяют инвазивные и неинвазивные инфекции. К первым относят заболевания, при которых возбудитель выделен из стерильных в норме локусов (например, спинномозговой жидкости, крови и др.). К неинвазивным инфекциям, соответственно, относятся локальные поражения (например, средние отиты, синуситы, хронический бронхит в стадии обострения и пр.) [1].
S. pneumoniae является одним из основных возбудителей внебольничных инфекций дыхательных путей (внебольничной пневмонии, обострений хронического бронхита, острого среднего отита и синусита). По данным официальной статистики в России ежегодно регистрируется около 400 000 случаев пневмонии, хотя их предполагаемое число превышает 1 500 000, при этом пневмококк является основным возбудителем внебольничной пневмонии (до 60%) [4]. В этиологии острого среднего отита главная роль также отводится пневмококку [5]. Помимо вышеперечисленных заболеваний пневмококк может вызывать менингит, бактериемию, первичный перитонит. Пневмококковые менингиты занимают ведущее место в структуре бактериальных менингитов неменингококковой этиологии [12].
Отмечаемое во многих странах нарастание антибиотикорезистентности S. pneumoniae оказывает влияние на выбор препаратов для эмпирической терапии. Для оптимизации эмпирической терапии пневмококковых инфекций требуются достоверные региональные и локальные данные о резистентности возбудителя к антимикробным препаратам. Эти данные могут быть получены путем мониторинга резистентности клинических штаммов S. pneumoniae. Пневмококк относится к «привередливым» микроорганизмам, поэтому исследование его чувствительности является трудоемким и дорогостоящим процессом, требующим специальных питательных сред и реагентов [13].
Пенициллинорезистентные пневмококки встречаются во всех странах мира (рис. 1), однако их частота варьирует в значительной степени. В 1980-х годах был определен механизм резистентности к пенициллину и другим ß-лактамным антибиотикам, который заключается в изменение мишени действия этого класса антибиотиков – пенициллинсвязывающих белков (ПСБ). ПСБ являются ферментами, катализирующими важные этапы синтеза пептидогликана. Результатом взаимодействия ß-лактамов с ПСБ является формирование ковалентно связанного через активный сериновый центр комплекса. Изменения ПСБ приводят к снижению связывания этого класса антибиотиков, результатом чего является потребность в их более высоких концентрациях для подавления активности ПСБ [1].
В 1990-х годах из многих стран мира стали поступать сообщения об увеличивающейся частоте пенициллинонечувствительных пневмококков, и к настоящему времени эта проблема приобрела глобальный характер.
Существует множество программ эпидемиологического надзора за антимикробной резистентностью пневмококков (SENTRY, PROTEKT, TRUST, CROSS, BASKETT и др.), однако для получения сравнимых данных состояния проблемы приоритетным является использование данных одного проекта, проводимого с начала 90-х гг. – проекта Александр [6,7,8,11].
С учетом данных этого проекта представляется возможным выделение наиболее «проблемных» с точки зрения распространенности пенициллинонечувствительности регионов/стран, которыми являются:
●в Азии – Гонконг, Япония, Сингапур, Корея, Таиланд, Тайвань;
●в Европе – Испания, Венгрия, Франция, Португалия, Румыния, Болгария, Турция;
●в Африке – ЮАР;
●в Северной и Южной Америке – Мексика, США (Юго-Восточные штаты и Аляска), Бразилия.
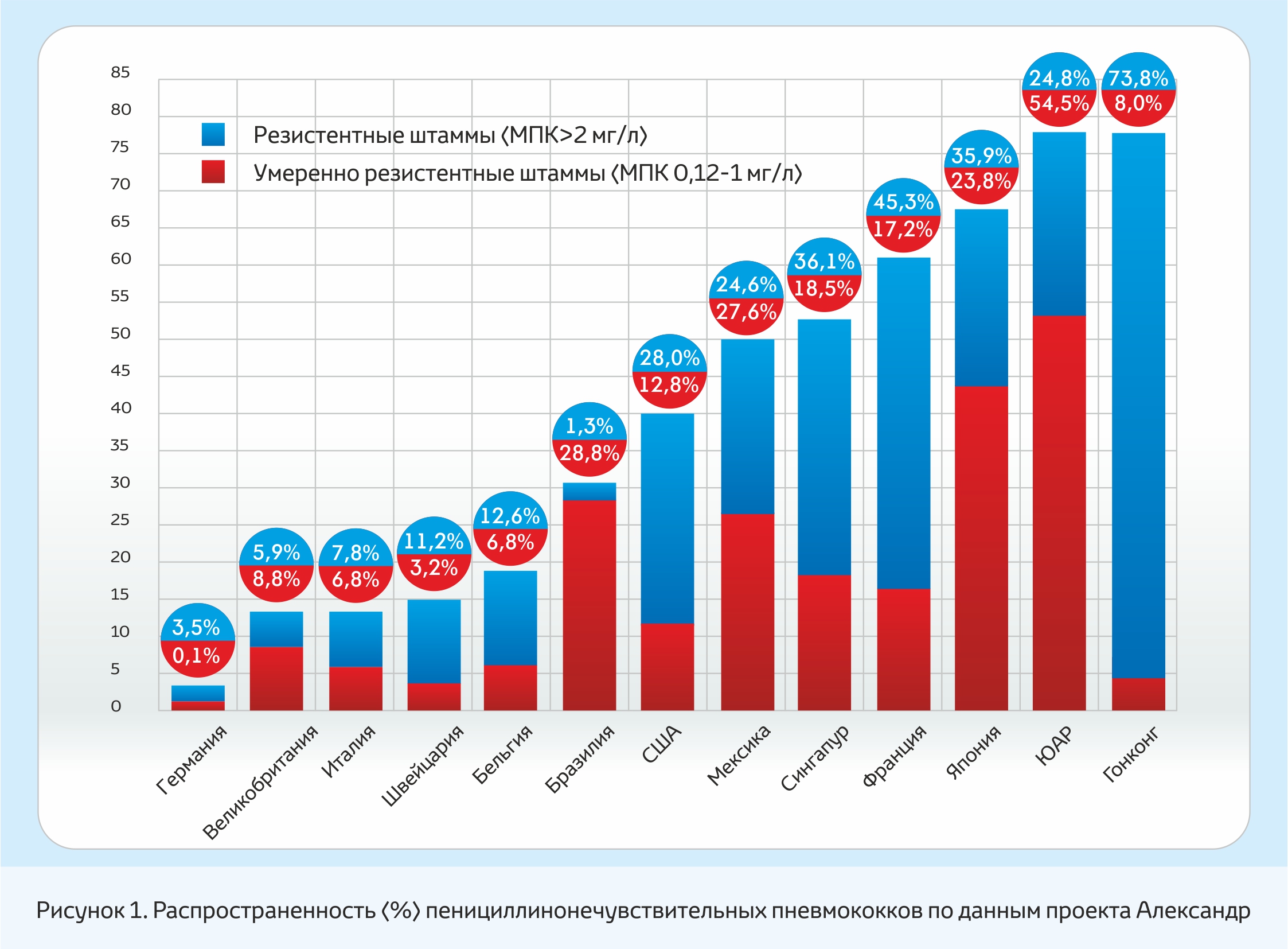
Наиболее благоприятная ситуация отмечается в Германии, Италии, Великобритании, Нидерландах, Канаде.
Кроме устойчивости к пенициллину в последние годы все большую проблему приобретает резистентность пневмококков к макролидным антибиотикам (рис. 2), хлорамфениколу, тетрациклинам и к ко-тримоксазолу [6,7,9,10,11].
Резистентность к макролидам, в частности, к эритромицину, была очень редким явлением в конце 1970-начале 80-х гг. Однако, уже в конце 80-х. гг. исследования в ЮАР показали высокую частоту эритромицинорезистентных штаммов в сочетании с полирезистентностью пневмококков, выделенных от здоровых детей.
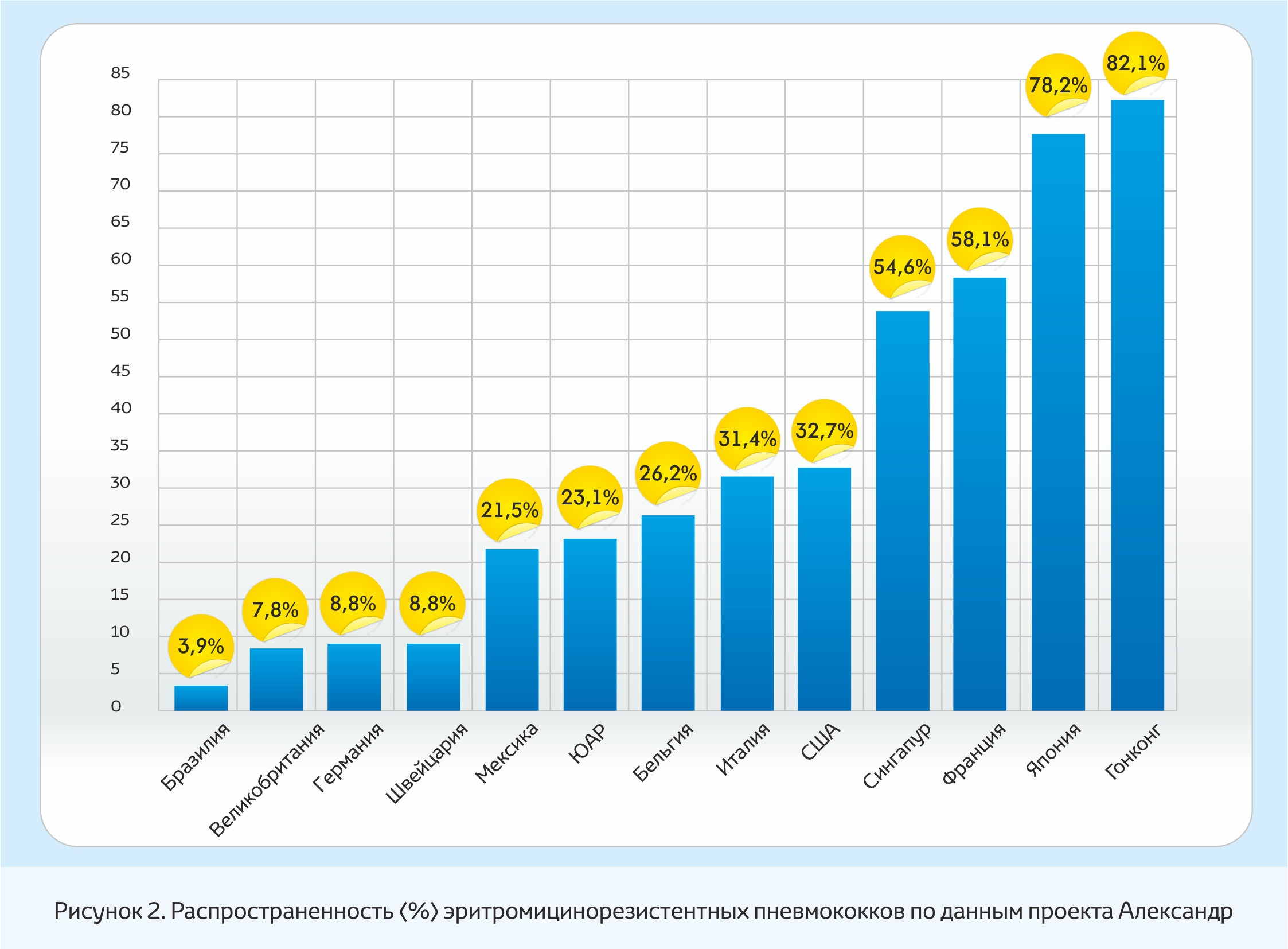
На основании представленных на рис. 2 данных, можно выделить следующие группы стран по частоте встречаемости макролидорезистентных пневмококков:
●страны со сравнительно низкой частотой резистентности – Бразилия, Германия, Великобритания, Швейцария;
●страны с умеренно высокой частотой резистентности – Мексика, ЮАР, Бельгия;
●страны с очень высокой частотой резистентности – США, Сингапур, Франция, Япония, Гонконг.
Большое клиническое значение имеет знание механизмов резистентности к макролидным антибиотикам. Выделяют три основных механизма резистентности к макролидам и линкозамидам:
1)изменение мишени действия в результате метилирования или мутации, результатом которого является невозможность связывания антибиотика с рибосомой;
2)активный выброс (эффлюкс) антибиотика из бактериальной клетки;
3)ферментативная инактивация антибиотика.
В 1956г. резистентность к эритромицину, механизм которой был связан с метилированием рибосомальной мишени действия антибиотиков, что в конечном итоге приводило к перекрестной резистентности к макролидам, линкозамидам и стрептограминам Б (MLSВ фенотип), была впервые описана у стафилококков. Позднее было выяснено, что данный механизм кодируется группой генов, названных erm (erythromycin ribosome methylase), которые встречаются у многих микроорганизмов, включая пневмококки. У пневмококков резистентность к макролидам, линкозамидам и стрептограминам кодируется генами erm В или, гораздо реже, erm А. Подобный фенотип характеризуется высоким уровнем перекрестной резистентности к макролидам и линкозамидам. С клинической точки зрения 14-, 15-, 16-членные макролиды и линкозамиды будут являться неэффективными при лечении инфекций, вызванных любыми подобными штаммами [10].
Механизм активного выброса (эффлюкса), кодируемый генами mef E и mef A, был описан у клинических штаммов пневмококка в 1997г. Важной особенностью механизма активного выброса является то, что он обуславливает резистентность к 14- и 15-членным макролидам при сохранении чувствительности к 16-членным, линкозамидам и стрептограмину Б (М-фенотип).
Также следует помнить, что у одного штамма возможно наличие и гена mef, и гена erm, что приводит к MLSВ типу резистентности.
Следует помнить, что существуют значительные различия между странами и в частоте встречаемости механизмов резистентности к макролидам. Так, например, в США механизм эффлюкса встречается у 70% макролидорезистентных пневмококков по сравнении с 6% в Италии. В то же время, метилирование рибосом и эффлюкс встречаются одинаково часто во многих азиатских странах [11].
Таким образом, пневмококки обладают уникальными возможностями выработки резистентности к различным классам антимикробных препаратов, что подтверждается современными эпидемиологическими данными. Существенные географические различия в распространенности, уровнях и механизмах снижения чувствительности диктуют необходимость проведения исследований этого феномена на национальном, региональном и локальном уровнях в каждой стране. Именно на основании этих данных можно разработать рекомендации по эмпирической терапии пневмококковых инфекций в каждом регионе.
Мониторинг антибиоткорезистентности пневмококков в Российской Федерации проводится с 1999г. НИИ антимикробной химиотерапии и Научно-методическим центром Минздрава России по мониторингу антибиотикорезистентности (г. Смоленск) и является составной частью многоцентрового исследования ПеГАС-1 ПеГАС-2 (1999-2005 гг.).
Целью данного исследования явилось изучение уровня, структуры и фенотипов резистентности к антимикробным препаратам в различных регионах России, а также оценка их в динамике в период с 1999 по 2005 гг. [1,2,13]
Фаза «А» проекта ПеГАС-1 была проведена в 1999-2000гг. с включением 15 центров Центрального, Приволжского, Южного, Уральского и Сибирского федеральных округов. По данным этого исследования (рис.3) умеренно резистентные к пенициллину штаммы S. pneumoniae составили 7%, при этом 2% штаммов имели МПК пенициллина ≥2 мг/л. Все штаммы с промежуточной устойчивостью к пенициллину сохраняли чувствительность к цефалоспоринам. Частота резистентности к эритромицину составила 6,2%. Наиболее существенной проблемой является устойчивость S. pneumoniae к тетрациклину (27,1%) и к ко-тримоксазолу (32,4%).
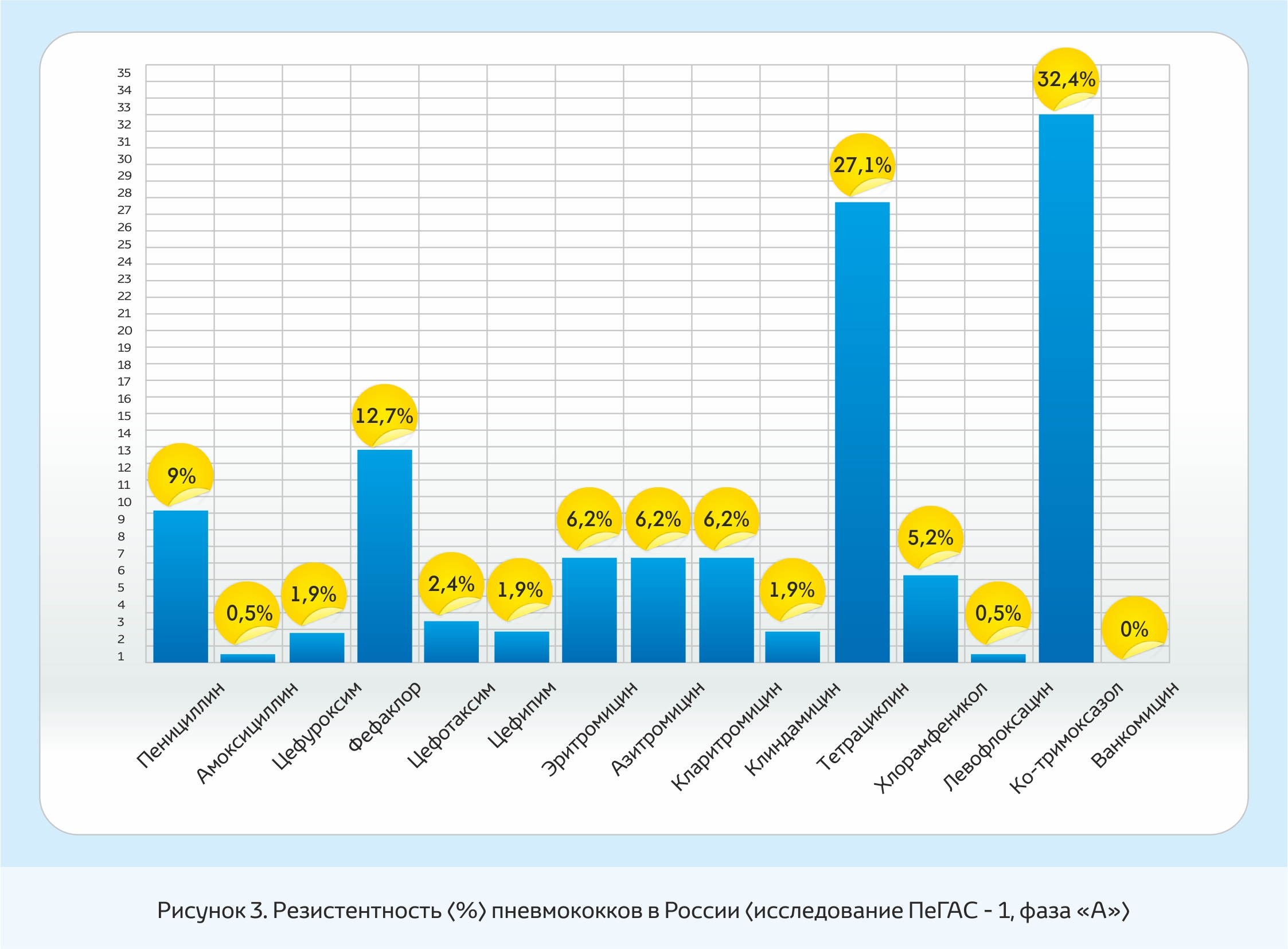
В фазе «Б» (2001-2002гг.) участвовали 25 центров Центрального, Северо-Западного, Приволжского, Южного, Уральского, Сибирского и Дальневосточного федеральных округов.
Установлено, что в настоящее время в России и, очевидно, в Беларуси все макролиды сохраняют высокую активность в отношении S. pneumoniae. В 1999-2003гг. нечувствительными к эритромицину были 8,2% штаммов, к азитромицину – 8,1%, к кларитромицину – 8%. Отмечена некоторая тенденция к снижению этих показателей в 2004-2005 гг. когда соответствующие величины составили 6,6%, 6,4% и 6,4% соответственно, однако различия между двумя периодами были статистическими недостоверными [1,2,13].
В результате проведенных в РФ исследований рекомендации по эмпирической терапии инфекций предположительно пневмококковой этиологии могут быть сформулированы следующим образом:
1) при лечении нетяжелых инфекций дыхательных путей (внебольничная пневмония, средний отит, синусит) следует использовать пероральную терапию. Препаратами выбора являются пенициллины, включая аминопенициллины (амоксициллин и амоксициллин/клавуланат), а также 14-, 15- и 16-членные макролиды (азитромицин, кларитромицин, спирамицин). В качестве альтернативы могут быть использованы – «респираторные» фторхинолоны (левофлоксацин, моксифлоксацин), цефалоспорины 2-3 поколения (цефуроксим, цефуроксим аксетил, цефотаксим, цефтриаксон), линкозамиды (клиндамицин).
2) при лечении тяжелых инфекций часто требуется парентеральная терапия. В качестве антибиотиков выбора можно использовать амоксициллин/клавуланат, цефотаксим, цефтриаксон, цефепим. Альтернативными препаратами являются «респираторные» фторхинолоны (моксифлоксацин, левофлоксацин) и карбапенемы.
3) при лечении инвазивных инфекций (например, менингита), препаратами выбора являются цефалоспорины 3-4 поколения (цефотаксим, цефтриаксон или цефепим), а альтернативой может быть ванкомицин в комбинации с рифампицином или хлорамфениколом.
Учитывая сравнительно высокую частоту нечувствительных штаммов, следует ограничить использование ко-тримоксазола и тетрациклина.
На сегодняшний день азитромицин является наиболее часто назначаемым макролидом в силу своих уникальных фармакокинетических и фармакодинамических свойств, что позволяет ему на протяжении уже более 10 лет быть одним из востребованных макролидных антибиотиков при разных видах инфекционных заболеваний.
Азитромицин является первым представителем 15-членных макролидных антибиотиков, формирующих подкласс азалидов. Он имеет следующие преимущества перед эритромицином: лучше действует на грамотрицательную флору, особенно на гемофильную палочку; не разрушается в кислой среде; создает значительно более высокие и стабильные концентрации в тканях; имеет длительный период полувыведения, что дает возможность принимать его один раза в день; используется коротким курсом – 3 или 5 дней, а при остром урогенитальном хламидиозе – однократно; реже вызывает нежелательные реакции и лекарственные взаимодействия; действует на M. avium.
Азитромицин проявляет постантибиотический эффект против таких микроорганизмов, как пиогенный стрептококк, пневмококк, гемофильная палочка, легионелла. Причем по продолжительности постантибиотического эффекта у гемофильной палочки и легионеллы он превосходит кларитромицин [16,17].
По данным большого числа исследований, макролиды, особенно азитромицин, обладают противовоспалительным, иммуномодулирующим и мукорегулирующим действием. Эти свойства макролидов связаны с их модулирующим влиянием на фагоцитоз, хемотаксис, киллинг, апоптоз нейтрофилов [18,19].
Нежелательные реакции при применении азитромицина развиваются редко. Как правило, они проявляются умеренно выраженными реакциями со стороны желудочно-кишечного тракта в виде болей, тошноты, диареи и в подавляющем большинстве случаев не требуют преждевременной отмены препарата. По данным нескольких контролируемых исследований, частота диспепсических расстройств при назначении азитромицина составляет 6-9% [20,21,22]. Особенности фармакокинетики позволяют принимать его один раз в день, что обеспечивает высокую комплаентность лечения.
Высокая эффективность азитромицина при инфекциях верхних и нижних дыхательных путей, таких как тонзиллофарингит, острый средний отит, синусит, бронхит и внебольничная пневмония, доказана многими контролируемыми исследованиями, причем не выявлено достоверной разницы при сравнении клинической и бактериологический эффективности азитромицина, назначаемого 3-х и реже – 5-дневным курсом, с другими макролидами, пероральными пенициллинами и цефалоспоринами, длительность применения которых при данных инфекциях составляет 7-10 дней [23-31].
Применение азитромицина при инфекциях нижних отделов дыхательных путей основано на его способности создавать высокие и длительно поддерживающиеся концентрации в бронхиальном секрете, слизистой бронхов, легочной ткани и жидкости, выстилающей эпителий альвеол. Как известно, азитромицин обладает высокой активностью как против классических (S. pneumoniae, H. influenzae, M. catarrhallis), так и «атипичных» респираторных патогенов (С. pnemoniae, M. pnemoniae, Legionella spp.).
Макролиды (азитромицин и кларитромицин) являются препаратами выбора при лечении внебольничной пневмонии у пациентов в возрасте до 60 лет, у которых отсутствуют сопутствующие заболевания и/или факторы риска [32]. У госпитализированных пациентов со среднетяжелым и тяжелым течением внебольничной пневмонии добавление макролидов к терапии бета-лактамами в первые 24 ч после поступления в стационар достоверно улучшает прогноз заболевания [33].
Проблема резистентности грамположительных патогенов к азитромицину в Беларуси пока не является актуальной.
 Было проведено исследование клинической эффективности азитромицина («Азикар», производство компании «Pharmacare Int. Co.») при инфекциях верхних и нижних дыхательных путей (ИДП) легкой и средней степени тяжести на амбулаторном этапе терапии. В исследование были включены 45 пациентов с ИДП предположительно пневмококковой этиологии (острый тонзиллофарингит, острый бактериальный риносинусит, острый средний отит, инфекционное обострение хронической обструктивной болезни легких). Больные были рандомизированы на две группы. Первая группа (25 чел) получала Азикар по 500 мг перорально один раз в день в течение 3 дней. Вторая группа (20 чел) получала амоксициллин по 500 мг три раза в день в течение 7-10 дней в зависимости от патологии. В исследование не включались пациенты с вирусными инфекциями дыхательных путей.
Было проведено исследование клинической эффективности азитромицина («Азикар», производство компании «Pharmacare Int. Co.») при инфекциях верхних и нижних дыхательных путей (ИДП) легкой и средней степени тяжести на амбулаторном этапе терапии. В исследование были включены 45 пациентов с ИДП предположительно пневмококковой этиологии (острый тонзиллофарингит, острый бактериальный риносинусит, острый средний отит, инфекционное обострение хронической обструктивной болезни легких). Больные были рандомизированы на две группы. Первая группа (25 чел) получала Азикар по 500 мг перорально один раз в день в течение 3 дней. Вторая группа (20 чел) получала амоксициллин по 500 мг три раза в день в течение 7-10 дней в зависимости от патологии. В исследование не включались пациенты с вирусными инфекциями дыхательных путей.
Клиническая эффективность лечения оценивалась дважды – в конце терапии и через две недели после проведенной терапии. Учитывалась вся совокупность клинических симптомов инфекций дыхательных путей (боль в горле, отёк и покраснение задней стенки глотки, экссудативные выделения, увеличение шейных лимфатических узлов, головная боль, продуктивный кашель, насморк). Короткий курс Азикара и стандартный курс амоксициллина были практически одинаковы по клинической эффективности. Клиническая эффективность лечения (нормализация температуры тела, исчезновение лейкоцитоза и субъективное улучшение) в обеих исследуемых группах была сопоставимой и составила, соответственно, 88% и 85%. В ходе лечения пациенты, принимавшие Азикар, отмечали более быстрое исчезновение симптомов заболевания.
Представленные данные свидетельствуют о высокой эффективности терапии инфекций верхних и нижних дыхательных путей предположительно пневмококковой этиологии препаратом «Азикар» (азитромицин). Отсутствие побочных эффектов и хорошая переносимость лекарственного средства подтверждают имеющиеся литературные данные о высокой комплаентности терапии азитромицином. Таким образом, на сегодняшний день азитромицин, назначаемый коротким курсом, продолжает оставаться одним из важнейших препаратов современной антибактериальной терапии, как в амбулаторных, так и стационарных условиях и препаратом выбора в терапии пневмококковых инфекций.
Литература:
1. Козлов Р.С. Пневмококки: прошлое, настоящее и будущее. Смоленск: Смоленская государственная медицинская академия, 2005. – 128с.
2. Страчунский Л. С., Козлов С. Н. Современная антимикробная химиотерапия. Руководство для врачей. – М.: Боргес, 2002. – 107-110.
3.Медицинская микробиология под редакцией Покровского В.И. и Поздеева О.К. Семейство Streptococcaceae. – Гэотар Медицина. Москва. – 1999г.; 193-206.
4.Синопальников А.И. Внебольничные инфекции нижних дыхательных путей. Пневмония. Под ред. Чучалина А.Г., Синопальникова А.И., Страчунского Л.С. М.: Медицинское информационное агентство; 2006. с. 17-50.
5. Casey J.R., Pichichero M.E. Changes in frequency and pathogens causing acute otitis media in 1995-2003. Pediatr Infect Dis J 2004; 23:824-8.
6. The Alexander Project 1998-2000: susceptibility of pathogens isolated from community-acquired respiratory tract infections to commonly used antimicrobial agents / Jacobbs M. R., Felmingham D., Appelbaum P. C., et al.// J. Antimicrob. Chemother. – 2003. – Vol. 52. – P. 229-246.
7. Appelbaum P. C. Antimicrobial resistance in Streptococcus pneumoniae: an overview // Clin. Infect. Dis. – 1992. – Vol. 15. – P. 77-83.
8. Baquero F. Pneumococcal resistance to β-lactam antibiotics: a global geographic overview // Microb. Drug Resist. – 1995. – Vol. 1. – P. 115-120.
9. Nomenclature for macrolide and macrolide-lincosamide-streptogramin B resistance determinants / Roberts M. C., Sutcliffe J., Courvalin P., et al. // Antimicrob. Agents Chemother. – 1999. – Vol. 43. – P. 2823-2830.
10. Identification of an erm (A) erythromycin resistance methylase gene in Streptococcus pneumoniae isolated in Greece / Syrogiannopoulos G. A., Grivea I. N., Tait-Kamradt A., et al. // Antimicrob. Agents Chemother. – 2001. – Vol.45. – P. 342-344.
11. Antimicrobial resistance among Clinical Isolates of Streptococcus pneumoniae in the United States during 1999-2000, Including a Comparison of Resistance Rates since 1994-1995 / Doern G. V., Heilmann K. P., Huynh H. K., et al. // Antimicrob. Agents Chemother. -2001. – Vol.45. – P. 1721-1729.
12.Королева И.С., Белошицкий Г.В., Лыткина И.Н., и соавт. Этиология и лабораторная диагностика гнойных бактериальных менингитов. Эпидемиол. и инфекц. бол. 2005;(3):5-9.
13. Козлов Р.С. и соавт. Резистентность S. pneumoniae в России в 1999-2005гг. КМАХ. 2006; 8(1):33-48.
14. Djokic S., Kobrehel G., Lazarevski G. Antibacterial in vitro evaluation of 10-dihydro-l0-deoxo-11-azaerythromycin A: synthesis and structure activity relationship of its acyl derivatives. J. Antibiot., 1987, 40: 1006-1015.
15. Scorneaux B., Ouadrhiri Y., Anzalone G., et al. Intracellular activity of azithromycin in relation to its cellular disposition towards bacteria infecting distinct subcellular compartments. In: The 3rd International Conference on the Macrolides, Azalides and Streptogramins. Lisbon, 1996: abstr. 4.17.
16. Odenholt-Tornqvist I., Lowdin E., Cars 0. Postantibiotic effects and postantibiotic sub-MIC effects of roxithromycin, clarithromycin, and azithromycin on respiratory tract pathogens. Antimicrob. Agents Chemother., 1995, 39: 221-226.
17. Fang G.D., Stout J.E., Yu V.L, Comparison of intracellular postantibiotic effect of azithromycin and clarithromycin vs. erythromycin against Legionella pneumophila serogroup 1. In: The 36th International Conference on Antimicrobial Agents and Chemotherapy, New Orleans, 1996; abstr. A91.
18. Woo P.C., Lau S.K., Yuen K.-Y. Macrolides as immunomodulatory agents. Curr Med Chem – Anti – Inflammatory & Anti – Allergy Agents 2002; 1:131-41.
19. Culic O., Erakovic V., Pamham M.J. Anti – Inflammatory effects of macrolide antibiotics. Eur J Pharmacol 2001; 429:209-29.
20. Weippl G. Multicentre comparison of azithromycin versus erythromycin in the treatment of pediatric pharyngitis or tonsillitis caused by group A streptococci. J. Antimicrob. Chemother., 1993, 31 (suppl. E): 95-101.
21. Muller 0. Comparison of azithromycin versus clarithromycin in the treatment of patients with upper respiratory tract infections. J. Antimicrob. Chemother., 1993, 31 (suppl. E): 137-146.
22. Bradbury F. Comparison of azithromycin versus clarithromycin in the treatment of patients with lower respiratory tract infections. J. Antimicrob. Chemother., 1993, 31 (suppl. E): 153-162.
23. Hooton T.M. A comparison of azitromycin and penicillin V for the treatment of streptococcal pharyngitis. Am J Med 1991; 91:23S-26S.
24. Ioannidis J., Contopoulos-Ioannidis D., Chew P., Lau J. Meta-analysis of randomized controlled trials on the comparative efficacy and safety of azitromycin against other antibiotics for upper respiratory tract infections. J Antimicrob Chemother 2001; 48:677-89.
25. Dunne M.W., Latiolais T., Lewis B., et al. Randomized, double-blind study of the clinical efficacy of 3 days of azitromycin compared with co-amoxiclav for the treatment of acute otitis media. J Antimicrob Chemother 2003; 52:469-72.
26. Arguedas A., Emparanza P., Schwartz R.H., et al. A randomized, multicenter, double blind, double dummy trial of single dose azitromycin versus high dose amoxicillin for treatment of uncomplicated acute otitis media. Pediatr Infect Dis J 2005; 24:153-61.
27. Casiano R.R. Azitromycin and amoxicillin in the treatment of acute maxillary sinusitis. Am J Med 1991; 91 (Suppl A):83-90.
28. Clement P.A., de Gandt J.B. A comparison of the efficacy, tolerability and safety of azitromycin and co-amoxiclav in the treatment of sinusitis in adults. J Int Med Res 1998; 26:66-75.
29. Swanson R.N., Lainez-Ventosilla A., De Salvo M.C., et al. Once-daily azitromycin for 3 days compared with clarithromycin for 10 days for acute exacerbation of chronic bronchitis: a multicenter, double-blind, randomized study. Treat Respir Med 2005; 4:31-9.
30. Mertens J., van Barneveld P., Asin H., et al. Double-blind randomized study comparing the efficacies and safeties of a short (3-day) course of azitromycin and a 5-day course of amoxicillin in patients with acute exacerbation of chronic bronchitis. Antimicrob Agents Chemother 1992; 36:1456-9.
31. Biebuck X.A. and Azitromycin study group. Comparison of azitromycin and co-amoxiclav in the treatment of acute tracheobronchitis and acute infectious exacerbation of chronic bronchitis in adults. J Int Med 1996; 24:407-18.
32. Mandell L., Bartlett J., Dowell S., et al. Update of practice guidelines for management of community-acquired pneumonia in immunocompetent adults. Clin Infect Dis 2003; 37:1405-33.
33. Gleason P., Meehan T., Fine J. Associations between initial antimicrobial therapy and medical outcomes for hospitalized elderly patients with pneumonia. Arch Intern Med 1999; 159:2562-72.


